生物制药专业微生物学研究性实验教学的探索
作者: 田园
[摘 要] 山东第一医科大学生物制药专业学生开设了以“植物内生菌资源的开发利用”为主题的研究性实验,以培养学生的创新能力,提高学生的综合素质。从校园或泰山上采集植物样品,分离、鉴定并保藏其中的内生细菌、放线菌和霉菌,学习微生物的纯培养、显微观察、菌种保藏等各项基本操作技术。在引申实验中融入了分子生物学研究方法以及生物化学的研究方法。实验以植物内生菌为研究对象,使对学生的培养从大众化的共性培养转变为个性化的培养。
[关键词] 生物制药专业;研究性实验;植物内生菌
[基金项目] 2018年度山东第一医科大学教学课题“研究性教学在微生物实验教学中的探索”(XY2018072);2021年度山东省医药卫生科技发展计划项目“黄精叶斑病病害微观机制及其拮抗菌的生防作用探究”(202101060623)
[作者简介] 田 园(1988—),女,山东滨州人,博士,山东第一医科大学生命科学学院副教授,主要从事微生物制药研究。
[中图分类号] G642.1 [文献标识码] A [文章编号] 1674-9324(2024)12-0147-04 [收稿日期] 2023-01-12
生物制药专业作为与新兴技术、传统专业交叉融通发展的新工科专业,承担着为生物健康产业培育和输送具有综合素质的高质量应用型人才的重任。随着我国实行创新驱动发展战略、“中国制造2025”“互联网+”、“大众创业、万众创新”、新旧动能转换等国家发展战略,社会各界对创新型人才的需求也越来越大。创新型人才是由教育培养产生的[1],涵盖教学的各个领域,课堂教学与实践教育是培养人才的前沿平台。
“微生物学实验”是一门具有较强应用性和实践性的课程,对医学院校生物制药专业而言是十分重要的专业基础课。随着普通高等学校本科阶段教学整体质量改革与专业教学改革试点工程的持续推进,很多高校已经进行了“微生物学实验”课程的教学改革,通过整合优化教材实验内容及编排,增强学科实验活动的综合性和探究性,激发学生自主学习的兴趣,提高学生的综合素质和创新能力[2-4]。“微生物学实验”课程有利于学生进行较大规模的自主设计型研究性实验,对稳步提高学生的综合专业素质、全面培养学生的科研创新能力具有重要作用。
在“微生物学实验”中,不同环境中的微生物分离实验属于常规基础性实验,近年来,很多高校在实验方法上进行了相应的调整与改革[5-6]。作为医学院校,我们一直在积极探索既能利用自身特色又能培养学生创新能力的实验创新模式。近年来,植物内生菌因其种类的多样性和良好的生物活性而备受关注。我校校园植被丰富,学校有“百草园”中药植物种植园,作为每年的微生物菌株分离实验的来源之一。泰山国家级自然保护区有着极其丰富的野生植物资源,是植物内生菌研究材料的理想来源。我们设计了以“植物内生菌资源的开发利用”为主题的综合研究性实验,着力培养学生的科研思维、创新能力,提高学生的综合素质。
一、教学目标
(一)培养学生实践动手能力
学生能在药用植物园或者泰山亲自动手采集植物样品,带回实验室进行植物内生菌的分离,既能满足学生探究求知的好奇心,又能进一步培养他们的实践动手能力。
(二)加深学生对知识点的综合理解
研究性实验所涉及的实验技术包括微生物学的无菌操作、显微观察、分离纯化和菌的保存等基本操作技术,此外还有分子生物学和生物化学方面的实验方法和技术。学生经过实践,可以掌握并综合利用这些实践技能,对微生物资源的利用和微生物的多样性有更加深入的了解。
(三)培养学生的科研精神和创新能力
研究性实验进行过程中,难免会遇到一些新问题,学生通过自主查阅文献,学会独立解决相关问题,能够培养学生不怕挫折、敢于探索的科研精神;整理实验数据、分析实验结果、撰写实验论文的过程,能够较好地提高学生的创新能力。
二、实验设计
植物内生菌的分离、鉴定和保藏的学时数为16学时,每学期的实验人数在50人左右,每班10个组,每组4~5人。学生利用课外时间提前自行采集药用植物,开课时进行分菌工作。引申实验不在16学时内,主要针对有兴趣继续研究菌株的分类鉴定或生物活性的学生,每年参与引申实验的学生为10人左右,5人为一组,以科研小项目的形式进行,通常需要一学年的时间。
(一)培养基
参照《微生物学实验教程》[7]附录制备培养基,分别配制牛肉膏培养基、PDA培养基和高氏1号培养基,用于分离植物内生细菌、霉菌和放线菌。
(二)药用植物内生菌的分离纯化
取新鲜的药用植物组织(根、茎、叶、花、种子等),采用组织块培养法对植物内生菌进行分离与纯化[8],具体操作如下:第一步,用自来水将植物表面冲洗干净;第二步,在5%(V/V)次氯酸钠溶液中浸泡5 min,随后用无菌水漂洗4次并用无菌滤纸吸去残留水;第三步,用75%的乙醇溶液浸泡5 min,用无菌水漂洗4次并吸去残留无菌水;最后,将组织切成直径5 mm的小块,接种到固体培养基上。
分离纯化细菌时,平板置于37℃培养箱中培养2~3天,将组织块周围生长的细菌菌斑用接种环挑取到牛肉膏培养基上,采用四区划线法反复纯化直至获得纯净菌株。分离霉菌和放线菌时,平板置于28℃培养箱中培养5~7天,将组织块周围生长的菌丝用接种环挑取到相应的培养基上,采用四区划线法反复纯化直至获得纯净菌株。
(三)内生菌的形态学鉴定
菌落形态观察:观察内生菌在固体培养基上的菌落颜色、边缘形状和生长速度。
参照《微生物学实验教程》在第二周和第四周的内容,对内生菌进行显微形态观察:细菌采用革兰氏染色法[7]30-33进行观察,确定菌株为革兰氏阳性菌还是革兰氏阴性菌。放线菌和真菌分别采用插片培养和载片培养观察[7]51-54。
(四)内生菌的保藏
参照《微生物学实验教程》在第十三周的内容[7]165-166,真菌和放线菌采用斜面保藏法,细菌采用甘油保藏法。实验过程中一定要注意无菌操作。
(五)结果与分析
内生菌分离:要挑选不同形态的菌进行进一步的分离纯化,以确保分离获得的菌的种类数尽量多。另外,为保证分到的菌是内生菌,应将最后一次漂洗植物组织的水涂布于固体培养基中进行培养,培养3~7天后没有细菌或真菌长出,表明分离获得菌是内生菌,而不是环境中污染的菌。
内生形态学鉴定:为确保细菌革兰氏染色结果正确,应采用混菌染色法,即将分离获得的内生菌与已知的大肠埃希氏菌(G-)和四联球菌(G+)混合染色,若两个已知菌的染色结果正确,则能避免因操作不当引起的错误结果。观察放线菌时,应特别注意放线菌的基内菌丝、气生菌丝的粗细和颜色差异;放线菌的生长速度慢,培养周期较长,在操作中应特别注意无菌操作,严防杂菌污染。观察真菌时,要重点观察标本中气生菌丝和产孢子结构的形态及特征性构造,如曲霉的顶囊、足细胞,青霉的帚状枝等。
通过上述内生菌的分离和鉴定工作,学生需对比不同植物或相同植物不同组织部位的微生物的种类和数量有何不同,记录这些差异并进行讨论。
(六)引申实验
随着分子生态学等研究的不断深入,人们发现已经开发和鉴定的微生物菌种仅占微生物总体数量的1%左右,仍有极其丰富的未知微生物种群待开发[9]。从一些条件特殊的生态环境中更有可能分离到新的菌株,以及有重要应用价值的菌株。植物内生菌在与植物长期进化过程中,形成了独特的生理和代谢机制,更易产生多种活性物质,是尚未被完全开发的微生物资源[10-11]。
对已经获得的植物内生菌进行菌株的进一步鉴定,包括生理生化特征、16S rRNA基因测序和系统发育学分析,得到序列后在GenBank中进行序列比对,一致性小于97%的即为新菌种。分离到新菌种后,可就所做的工作和数据进行整理,发表文章。也可以对分离获得的内生菌进行生物活性研究,包括发酵液的制备和萃取,粗提物的抗细菌、抗真菌、抗氧化研究,获得活性结果后,可从活性方面进行数据的整理,发表文章。
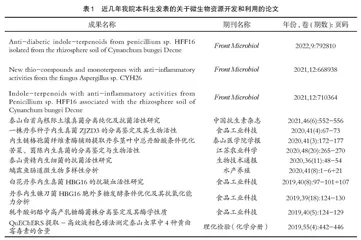
对学生而言,不仅进行了科研的锻炼,同时还培养了学术论文的撰写能力,发表核心期刊论文及SCI等高质量的学术论文。近几年,我专业本科生作为第一作者或参与作者发表的有关微生物资源开发利用方面的论文有10余篇,其中SCI收录的论文3篇,如表1所示。
结语
本研究性实验的目的旨在让学生了解植物样品采集、植物内生菌分离纯化、鉴定和保藏的基本方法,学习一系列微生物的基本操作技术。利用本课程的特点,将部分原本需要教师准备的实验样本改为由学生亲自采集,并将采集范围从熟悉的校园扩至野外,不仅极大地提高了实验的乐趣和学生的参与热情,还让学生从源头上理解了实验目的。这项微生物学的探究性实验具有较强的可操作性,费用没有增加,且极大地激发了学生的兴趣,取得了很好的教学成效。我专业以这种形式开展微生物学实验已有6年,不少学生还通过参与引申实验,提升了微生物学、分子生物学、生物化学实验技术的综合运用能力,初步体验了科学研究的具体流程,有些还取得了不错的研究结果,建立和培养了科研创新意识和自主创新能力。
本实验的创新点有两个:其一,植物内生菌本身是较新的一类微生物菌种资源,更易从中发现新的菌种或有活性的菌种,本科生经历了从常规的分离、形态观察到科研实验(新菌种的分离、分子生物学鉴定或活性测定)的过程,可以发表核心期刊或SCI论文。学生认识到从本科实验衍生到科研实验并不是非常困难的事情,消除了学生对科研的畏惧感和神秘感,提高了学生对科研的兴趣和自信,培养了学生的科研能力、创新意识和创新能力。其二,使共性教学转变为个性化培养。学生全部共同完成了植物内生菌的分离、形态观察和保藏实验,有兴趣的学生可以继续利用获得的微生物进行分类鉴定和活性筛选,有些学生还采集自己家乡的特有植物进行内生菌的分离鉴定工作。本实验使单纯的微生物分离实验衍生为有难度、复杂的科研实验,使对于学生的培养从大众化的共性培养逐步转化为个性化的有兴趣、有潜力的培养和挖掘。
参考文献
[1]陈向东,唐晓峰,朱应,等.武汉大学微生物学系列课程国家级教学团队的特色与建设思路[J].微生物学通报,2009,36(12):1931-1934.
[2]洪龙.北京大学微生物学实验课模块化教学的探索[J].微生物学通报,2014,41(4):744-747.
[3]崔战利,刘永春,张鸿雁,等.微生物学模块式自设计研究性实验的构建与教学实践[J].微生物学通报,2017,44(3):732-738.
[4]王素英,张宏宇,杨晓丽.项目驱动的实验教学新模式的构建与实践:以微生物学实验为例[J].微生物学通报,2018,45(3):702-707.
[5]戴亦军,何伟,袁生,等.模块化微生物学实验课教学体系的探索与实践[J].微生物学通报,2015,42(9):1809-1816.
[6]李雪玲,胡文锋,廖振林,等.探究式教学模式在“食品微生物学”实验教学中的实践[J].农产品加工,2017(24):74-76+79.
[7]徐德强,王英明,周德庆.微生物学实验教程[M].北京:高等教育出版社,2019.
[8]郭晓平,刘兴飞,李晓楠,等.泰山黄精内生细菌的抗菌活性研究[J].生物技术通报,2020,36(11):48-54.
[9]WALSH C T, FISCHBACH M A. Natural products version 2.0: connecting genes to molecules[J]. Journal of the American chemical society,2010,132(8):2469-2493.