基于三重表征和模型认知的化学基本概念教学
作者: 韩雪松 刘志峰
[摘 要]基于发展学生化学学科核心素养的目标,开展“氧化还原反应”这一基本概念的教学。首先深入挖掘教材,从宏观辨识、微观探析、符号表征三个方面依次展开,然后建构氧化还原反应认知模型,再指导学生运用该模型去深入理解元素化合物知识,体会三重表征和模型认知对学习化学基本概念的指导作用。
[关键词]三重表征;模型认知;基本概念教学;氧化还原反应
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2025)05-0057-05
一、问题的提出
《普通高中化学课程标准(2017年版2020年修订)》明确指出,高中化学教学以发展学生化学学科核心素养为主旨,教师应重视教学内容的结构化设计,结合具体的化学教学内容的特点和学生的实际,引导学生开展分类与概括、证据与推理、模型与解释、符号与表征等具有学科特质的学习活动[1]。在高中化学课堂教学中,改变知识本位的教学观,立足学科本质和课程标准来分析教材内容,探究知识之间的内在联系,发掘化学知识的素养功能,帮助学生建构学科基本观念,是贯彻新课标要求的有效途径。
化学基本概念内容与元素化合物内容相辅相成,在现行几个版本的高中化学必修教材中,这两部分内容多交叉编排,尤其在苏教版教材中,氧化还原反应、离子反应没有单独设章节,而是分别编排在“氯气及氯的化合物”“金属钠及钠的化合物”单元中。元素化合物内容的学习为理解化学基本概念做了必要铺垫,而对基本概念的深入认识又能帮助学生更好地理解元素化合物的性质。
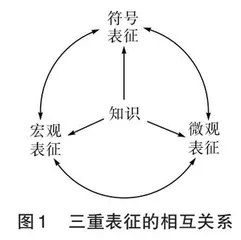
三重表征包括宏观表征、微观表征、符号表征。宏观表征主要是指物质在物理和化学变化中表现出来的、可以直接观察到的宏观现象在学习者头脑中的反映;微观表征主要是指有关物质的微观组成和结构、微观粒子的运动及相互作用等微观属性在学习者头脑中的反映;符号表征主要是指由拉丁文或英文字母组成的符号及图形符号在学习者头脑中的反映。这三种表征形式相互关联,共同构成化学知识的完整表征体系,体系中各要素的具体关系如图1所示。从宏观、微观、符号三种表征水平上认识和理解化学知识,是化学学习者特有的思维方式[2]。利用三重表征的思维方式学习和理解化学基本概念,再用化学基本概念指导和辅助元素化合物知识的学习,是一个知识关联和结构化的过程,有助于学生建构系统性的化学知识框架。
二、教学背景分析
(一)课标要求
新课标对氧化还原反应的内容要求为:认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是电子的转移,知道常见的氧化剂和还原剂。此外,新课标还给出了教学策略提示:创设丰富多样的真实问题情境,发挥核心概念对元素化合物学习的指导作用[3]。
(二)教材分析
“氧化还原反应”是苏教版高中化学必修第一册专题3第一单元第3课时的内容。氧化还原反应是非常重要的化学基本概念,是分析物质化学性质、学习电化学等知识的必备工具,在整个高中化学中具有极其重要的地位。
横向来看,“氧化还原反应”在不同版本教材中的出现顺序有很大区别:在人教版教材中,氧化还原反应、离子反应等基本概念集中编排在必修第一册第一章,在这些概念的基础上再进行元素化合物知识的学习(第二章、第三章、第五章)[4-5];而苏教版教材将化学基本概念与元素化合物知识交叉编排,本课时“氧化还原反应”就编排在“氯气的性质及应用”之后[6]。氯气的性质及应用能够为分析理解氧化还原反应提供贴近学生认知的教学情境,而氧化还原反应作为核心概念,将对后续元素化合物知识的学习起到重要的指导作用。因此,在本节课的教学中,在学生理解氧化还原反应的本质后,教师还要引导学生运用氧化还原反应理论来理解元素及其化合物的性质。
纵向来看,根据学生的认识规律,苏教版教材将“氧化还原反应”这一基本概念在必修第一册分三个层面渗透。首先是宏观辨识,即“氧化还原反应是有元素化合价变化的反应”(专题1第一单元);其次是微观探析,即“氧化还原反应是有电子转移的化学反应”(专题3第一单元);最后是守恒角度,即“氧化还原反应中得失电子总数一定相等”(专题4第二单元)[7]。本课时属于第二个层面,着重从微观角度理解氧化还原反应的本质,并用化学语言(双线桥)进行表示,实现宏观、微观、符号三重表征,为后续理解得失电子守恒打好基础。
(三)学情分析
学生在初中已接触过一些化学反应,在本节课之前还系统学习了氯及其化合物的性质,具备一定的元素化合物知识基础,知道氧化还原反应中元素化合价会发生变化,能够判断哪些反应是氧化还原反应,但不清楚氧化还原反应中元素化合价变化的根本原因。学习方式上,学生能在小组合作学习中积极思考、讨论探究,从而发现问题,分析并解决部分问题,但缺少从微观角度解释宏观现象的意识,不能主动运用氧化还原概念去系统理解元素化合物的性质,这些都需要教师进行及时适当的引导。
三、教学目标及重难点
(一)教学目标
1.通过从原子结构角度讨论化合价变化的原因,理解氧化还原反应的本质,培养从微观角度解释宏观现象的意识,发展“宏观辨识与微观探析”核心素养。
2.通过了解氧化还原反应理论发展的化学史,发展“科学态度与社会责任”核心素养。
3.通过讨论氧化剂、还原剂在氧化还原反应中的变化,建构氧化还原反应认知模型,发展“变化观念与平衡思想”“证据推理与模型认知”等核心素养。
4.掌握用双线桥表示氧化还原反应的方法,培养宏观、微观、符号三重表征的意识和能力。
5.通过从氧化还原角度理解氯气的性质,培养运用氧化还原反应理论学习元素化合物知识的意识。
(二)教学重难点
教学重点:理解氧化还原反应的本质,建构氧化还原反应认知模型。
教学难点:氧化还原反应的符号表征。
四、教学设计思路
本单元前两课时“氯气的发现与制备”及“氯气的性质及应用”为“氧化还原反应”的教学提供了丰富的情境素材。首先,通过氯气与金属钠的反应,可以引导学生从原子结构角度理解氧化还原反应的本质,即有电子的转移,进而分析电子转移与化合价升降、氧化还原反应之间的关系,并用化学用语(双线桥)进行表征。其次,介绍氧化剂、还原剂概念,并组织学生分组讨论氧化剂、还原剂在氧化还原反应中的一系列变化,建构氧化还原反应的认知模型。最后,引导学生从氧化还原角度总结归纳氯气的性质,分析氯元素的价-类二维图,掌握用氧化还原反应理论指导元素化合物学习的一般思路。
五、教学过程
环节一:复习导入,提供情境素材
导入:在这一单元的前两课时,我们学习了氯气的制备和性质。现在,让我们来回顾一下这些知识。请同学们尽可能多地书写出有关氯气的化学方程式。
学生活动:书写前两课时所学的与氯气相关的化学方程式,并派代表到黑板上进行板演。
过渡:氯气是一种活泼的非金属单质,可以发生很多反应。那么,我们该如何梳理出这些反应的结构化认知呢?通过今天的学习,我们将对氯气的性质有一个全新的认识。
设计意图:通过复习氯气的制备及性质,为接下来分析氧化还原反应提供情境素材。同时,通过设置悬念,激发学生的学习兴趣和探究欲望,让他们带着目的开启本节课的学习。
环节二:微观探析,认识氧化还原反应
问题:如何判断一个化学反应是不是氧化还原反应?
生:看有无元素化合价变化。
师:有元素化合价变化是氧化还原反应的特征。那么,元素化合价变化的本质是什么呢?我们以钠在氯气中燃烧为例,从原子结构角度进行讨论。在反应中,钠原子失去电子变成钠离子,氯原子得到电子变成氯离子,钠离子与氯离子结合形成氯化钠(如图2)。
得出结论:氧化还原反应是有电子转移的化学反应。
问题:初中阶段我们认识的氧化反应、还原反应是怎样的?专题1第一单元是如何定义氧化还原反应的?现在,你又是如何理解氧化还原反应的?
生1:初中阶段我知道了“物质得氧的反应是氧化反应,物质失氧的反应是还原反应”。
点评1:这是从元素的角度来分辨的。
生2:专题1第一单元中将氧化还原反应定义为“有元素化合价变化的反应”。
点评2:这是从宏观现象来定义的。
生3:现在我知道“氧化还原反应是有电子转移的化学反应”。
点评3:这是从微观结构的角度来理解的。
化学史介绍:历史上氧化还原反应理论的发展经历了一个漫长的过程。化学家对氧化还原反应的认识也是由最开始的元素视角,到后来的化合价视角,再到现代化学原子结构理论支持下的电子转移视角,这是一个从宏观到微观、从表观到本质的认识深化过程。
设计意图:通过探究具体反应,利用图片使微观结构的变化可视化,让学生认识到,化合价变化是氧化还原反应的表观特征,发生电子转移才是其本质,培养学生从微观结构角度解释宏观现象的意识。
环节三:符号表征,表示氧化还原反应
归纳:氧化还原反应中的一系列变化可概括为“升失氧,降得还”(升:所含元素化合价升高,失:失去电子,氧:发生氧化反应;降、得、还则与之相反)。
讲解:如图3所示,将这一系列变化结合化学方程式用符号(双线桥)表示出来。
讲解书写原则:先标化合价,再看价变化;起止同元素,桥上标变化;上标升失氧,下标降得还;电子转移数,原数乘变价。
进阶:也可在心中默念“升失氧,降得还”,线桥上只标电子转移情况,具体如图4所示。
课堂练习:用双线桥表示下列反应的电子转移情况:①CO+CuO △Cu+CO2;②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+ 4H2O;③Cl2+2NaOH=NaCl+NaClO+H2O;④2H2S+SO2=3S+2H2O。
学生活动:思考并在纸上作答,然后派代表到黑板上进行板演。
问题:观察每一个氧化还原反应,它们的得、失电子数有何关系?反应③的元素化合价变化有什么特点?反应④的元素化合价变化有什么特点?(根据学生的回答初步渗透得失电子守恒规律、歧化反应和归中反应的概念。)
设计意图:在微观结构变化的基础上,进一步将其抽象为符号表征,实现宏观、微观、符号三重表征的融合,深化学生对氧化还原反应的认识,并在练习中初步渗透得失电子守恒的思想;通过口诀,帮助学生理解记忆,降低学生初学双线桥法的难度。
环节四:模型建构,认识氧化剂与还原剂
问题:以氢气还原氧化铜的反应为例,在该反应中,氢气发生了哪些变化?谁使得它发生了这些变化?氧化铜发生了哪些变化?又是谁使得它发生了这些变化?
生:氢气中氢元素化合价升高,氢原子失去电子,氢气发生了氧化反应,是氧化铜使它发生了这些变化。氧化铜中铜元素化合价降低,铜原子得到电子,氧化铜发生了还原反应,是氢气使它发生了这些变化。
师:因此我们说,氧化铜具有氧化其他物质的能力,即具有氧化性,在该反应中作氧化剂;氢气具有还原其他物质的能力,具有还原性,在该反应中作还原剂。
追问:仍以该反应为例,思考一下,在氧化还原反应中氧化剂会发生哪些变化?还原剂呢?
生:在氧化还原反应中,氧化剂得到电子,所含元素化合价降低,发生还原反应;还原剂失去电子,所含元素化合价升高,发生氧化反应。