高效液相串联质谱法测定马铃薯中α-茄碱
作者: 徐梦媛 钱秀荣 石飞云 王君君 黎俊宏*
摘 要:目的:建立高效液相色谱串联质谱法测定马铃薯中α-茄碱的方法。方法:以5%乙酸溶液作为提取溶液,样品经12 000 r·min-1低温离心后,取上清液1 mL经0.22 μm微孔滤膜过滤,然后使用0.1%甲酸水溶液-乙腈(90∶10,体积比)溶液进行稀释,经Waters BEH C18柱分离,以甲酸和0.1%甲酸水溶液为流动相,电离方式为喷雾正离子模式,检测模式为多反应监测模式,最终通过高效液相色谱串联质谱进行分析。结果:α-茄碱在2~200 ng·mL-1线性关系良好(r>0.999),方法检出限为0.1 ng·mL-1,定量限为0.3 ng·mL-1,平均加标回收率在93.2%~104.3%,相对标准偏差在3.2%~4.1%。结论:本研究所建立的方法方便快捷、准确度高、稳定性好,能够对马铃薯中α-茄碱进行定量分析。
关键词:高效液相色谱串联质谱法;马铃薯;α-茄碱
Abstract: Objective: To establish a high-performance liquid chromatography tandem mass spectrometry method for the determination of α - solanine in potatoes. Method: 5% acetic acid solution was used as the extraction solution. After the sample was centrifuged at a low temperature of 12 000 r·min-1, 1 mL of the supernatant was taken and filtered by a 0.22 μm microporous membrane. Then, 0.1% formic acid aqueous solution acetonitrile (90∶10, volume ratio) solution was used for dilution. After separation by Waters BEH C18 column, using formic acid and 0.1% formic acid aqueous solution as the mobile phase. The ionization mode was spray positive ion mode, and the detection mode was multi reaction monitoring mode. Finally, the analysis was performed by high-performance liquid chromatography tandem mass spectrometry. Result: The linear relationship of α - solanine was good between 2~200 ng·mL-1 (r>0.999), with a detection limit of 0.1 ng·mL-1 and a quantification limit of 0.3 ng·mL-1. The average recovery rate was 93.2%~104.3%, and the relative standard deviation was 3.2%~4.1%. Conclusion: The method established in this study is convenient, fast, accurate, and stable, and can quantitatively analyze alpha solanine in potatoes.
马铃薯作为一种重要的粮食作物,被广泛视为全球多个国家的关键食品之一,并被列入7种主要粮食作物之中,其重要性仅次于水稻、玉米和小麦[1-3]。马铃薯具有益气、健脾、和胃、解毒和消肿等功效,但值得注意的是,青紫皮或发芽的马铃薯中含有过量的龙葵素,含量可高达430 mg/100 g,而人体摄入0.2~0.4 g龙葵素就可能发生中毒[4-5]。
龙葵毒素,又称茄碱、龙葵碱或马铃薯毒素,是一种由葡萄糖残基和茄啶组成的弱碱性糖苷,存在于马铃薯、番茄及茄子这些茄科植物中[6]。当马铃薯发芽时,其内部的龙葵毒素含量会大幅增加。基于糖基种类的不同,龙葵碱可分为茄碱与卡茄碱两大类。在马铃薯中,α-茄碱为龙葵碱的主要成分,占总量的95%以上,且其毒性极强[7]。α-茄碱由疏水性的甾体苷元和亲水性的低聚糖侧链部分组成。后者主要由葡萄糖、半乳糖、鼠李糖等单糖单元构成[8],而糖苷配基部分则是由环戊烷多氢菲与含氮杂环结构相连而成。α-茄碱不溶于水、乙醚、氯仿,但能溶于乙醇,在碱性环境下能够保持稳定状态;而在中性或酸性条件下,α-茄碱的糖苷键容易发生水解反应,导致苷元和单糖的释放,从而减弱其毒性[9]。α-茄碱对胃肠道黏膜有较强的刺激性和腐蚀性,还会麻痹中枢神经系统,特别是对呼吸和运动中枢作用显著,表现为恶心、呕吐、腹泻等,严重者甚至可能导致死亡[10]。
目前,α-茄碱的检测方法多样,其提取技术主要包括以下几种。①水或酸水回流提取法。该方法基于碱性较强的生物碱在植物体内多以盐的形式存在且可溶于水的特性,通过水或酸水回流有效提取α-茄碱。②有机溶剂提取法。通常采用乙醇等有机溶剂对粉碎后的植物材料进行浸提,然后经过过滤、浓缩得到提取物。随着科技的进步,超声提取、微波辅助提取、超临界流体萃取、分子印迹技术和生物膜技术等新型提取方法逐渐应用于龙葵毒素的提取过程。这些新技术具有提取效率高、操作简便的优势,但具体应用时仍需考虑实验条件和目标产物纯度的要求。α-茄碱的检测方法主要包括色谱法(如薄层色谱法、气相色谱法、液相色谱法)、酶联免疫吸附测定法(Enzyme-Linked Immunosorbent Assay,ELISA)和生物传感器法[11-13]。色谱法是目前α-茄碱分析中最常用的方法,它能与多种检测仪器结合,实现定性和定量分析。ELISA以其快速、高灵敏度和强特异性著称,但其依赖特定抗体,且分析结果受温度波动的影响。相比之下,生物传感器法无须复杂的仪器设备,操作简便且迅速,适用于快速检测需求,但其易受环境中多种物质的干扰,稳定性较差。因此,建立一种操作简便、准确、快速的检测方法用于马铃薯中α-茄碱的测定显得尤为必要。
本文建立了一种测定马铃薯中α-茄碱的高效液相色谱串联质谱法,通过结合液相色谱和质谱检测器,实现快速、准确地检测马铃薯中α-茄碱。
1 材料与方法
1.1 材料与试剂
马铃薯,市售。
乙腈、甲酸、乙酸(色谱纯,德国默克公司);甲醇中α-茄碱标准溶液(100 μg·mL-1,天津阿尔塔公司)。
1.2 仪器与设备
LCMS-8060高效液相色谱-三重四极杆质谱仪,日本岛津公司;多点涡旋振荡器,德国海道尔夫公司;Milli-Q IQ 7000超纯水系统,美国密理博公司;超声仪,上海科导超声仪器有限公司;GM200粉碎机,德国莱驰公司;Centrifuge 5804 R冷冻离心机,德国艾本德公司。
1.3 实验方法
1.3.1 标准溶液配制
(1)标准储备液。准确移取100 μL甲醇中α-茄碱标准溶液(100 mg·L-1),用0.1%甲酸水∶乙腈(90∶10,体积比)定容,配制成1 μg·mL-1的标准储备液。
(2)标准曲线系列溶液。准确吸取20、50、100、200、500、1 000 μL和2 000 μL的标准储备液,用0.1%甲酸水∶乙腈(90∶10,体积比)定容至10.0 mL,配制成浓度为2、5、10、20、50、100 ng·mL-1和200 ng·mL-1的系列标准溶液。
1.3.2 样品前处理
将马铃薯带皮打碎,准确称取0.5 g(精确至0.001 g)均质样品于15 mL离心管中,加入4 mL 5%乙酸溶液,涡旋混匀后振荡提取2 h。在4 ℃下以12 000 r·min-1 离心10 min,吸取1 mL经0.22 μm水相滤膜过滤,滤液使用0.1%甲酸水溶液∶乙腈(90∶10,体积比)溶液稀释50倍后上机测定。
1.3.3 色谱条件
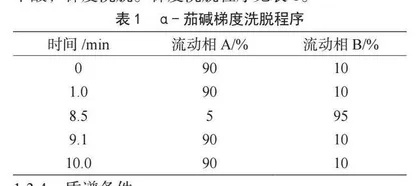
色谱柱:Waters BEH C18柱(100 mm×2.1 mm,1.7 μm);流量:0.3 mL·min-1;进样量:2 μL;柱温:40 ℃;流动相A为0.1%甲酸水溶液,流动相B为甲酸,梯度洗脱。梯度洗脱程序见表1。
1.3.4 质谱条件
离子源:电喷雾离子源;扫描模式:正离子模式;碰撞气:氮气;雾化气流量:3 L·min-1;加热气流量:10 L·min-1;干燥气流量:10 L·min-1;接口温度:300 ℃;脱溶剂温度:526 ℃;脱溶剂管温度:250 ℃;加热块温度:400 ℃。α-茄碱具体质谱参数见表2。
1.4 数据处理
采用岛津Labsolution软件进行数据处理。
2 结果与分析
2.1 流动相的选择
考察0.1%甲酸水溶液和甲醇、0.1%甲酸水溶液和乙腈、0.1%乙酸水溶液和甲醇3种流动相体系对α-茄碱的影响。结果显示,当流动相为0.1%甲酸水溶液和甲醇时,α-茄碱出峰时间较短且峰形良好,因此选择流动相体系为0.1%甲酸水溶液和甲醇。
2.2 方法学验证
2.2.1 线性参数、检出限和定量限
取通过1.3.1方法得到的系列标准溶液进行测定,以质谱响应强度作为纵坐标,以α-茄碱的浓度作为横坐标,绘制标准工作曲线,求回归方程和相关系数。α-茄碱在2~200 ng·mL-1线性关系良好,相关系数r>0.999,线性方程为y=98 277.1x+43 557.4。以3倍信噪比(S/N)计算检出限,以3倍检出限计算定量限。得出α-茄碱的检出限为0.1 ng·mL-1,定量限为0.3 ng·mL-1。
2.2.2 回收率与精密度
取空白马铃薯样品,按照低、中、高(10、50、100 ng·mL-1)3个水平浓度进行加标回收实验,每个水平平行测定6次,计算平均加标回收率和相对标准偏差(Relative Standard Deviation,RSD)。由表3可知,在3个添加水平下,α-茄碱的平均回收率在93.2%~104.3%,RSD在3.2%~4.1%。
2.3 实际样品检测
采用本试验方法对不同市场的50份马铃薯进行检测,结果显示,50份样品中均检测出α-茄碱,含量在10.192~76.605 μg·kg-1,但均未超出限量标准。
3 结论
本研究建立了一种高效液相色谱串联质谱法测定马铃薯中α-茄碱的方法。结果显示,α-茄碱在2~200 ng·mL-1线性关系良好,相关系数大于0.999;平均回收率在93.2%~104.3%,RSD在3.2%~4.1%。该方法灵敏度高,准确性好,能满足马铃薯中α-茄碱的实际检测需求。
参考文献
[1]聂利珍,张志成,谢锐,等.彩色马铃薯StANS1a基因的克隆及表达分析[J].华北农学报,2023,38(4):38-46.
[2]罗其友,刘洋,高明杰,等.中国马铃薯产业现状与前景[J].农业展望,2015,11(3):35-40.
[3]颉亚珍.我国马铃薯产量多年稳居世界第一[N].北京日报,2023-09-09(4).
[4]刘玉霖,李世伟,裴雅婷,等.马铃薯捕光色素结合蛋白基因StCP24的克隆及及其功能研究[C]//2024年第二十五届中国马铃薯大会论文集.北京:中国作物学会,2024:333-334.
[5]吕粉红,乔益,杜辰生,等.甘肃地区马铃薯良种繁育与高效栽培技术[J].种子科技,2024,42(24):49-51.
[6]张子妮,潘汝欣,武慧敏,等.龙葵碱检测技术研究进展[J].防化研究,2024,3(1):64-71.
[7]王可,陈龙星,田会方,等.高效液相色谱-串联质谱法测定凉拌菜中4种植物毒素[J].食品工业科技,2019,40(24):190-193.
[8]郭旭光.蔬菜毒素知多少[J].家庭医学,2023(9):38.
[9]杨柯.黄牛马铃薯中毒的治疗[J].吉林畜牧兽医,2020,41(9):74.
[10]李红红,张亚娟.26头猪马铃薯中毒的诊治体会[J].畜牧兽医杂志,2023,42(6):137-138.
[11]李美.马铃薯α-茄碱检测体系建立及其含量影响因素的研究[D].长沙:湖南农业大学,2013.
[12]孙玉婷,李寅.UPLC-MS/MS法检测中毒血液中α-茄碱和α-卡茄碱[J].山西化工,2024,44(6):61-62.
[13]卢嘉豪,张飞,林钦恒,等.固相萃取-液相色谱串联质谱测定饲料中的α-茄碱和α-卡茄碱[J].山东化工,2021,50(20):108-110.
基金项目:江苏省第六期“333高层次人才培养工程”第三层次培养对象[(2022)3-4-163];常州市“十四五”卫生健康高层次人才培养工程-拔尖人才(2022CZBJ099)。
作者简介:徐梦媛(1994—),女,安徽砀山人,硕士,主管技师。研究方向:理化检验。
通信作者:黎俊宏(1982—),男,湖南郴州人,硕士,副主任技师。研究方向:理化检验。E-mail: 41788950@qq.com。