乳矿物盐与牛磺酸复合片剂安全性与功能性
作者: 耿克军 刘欣
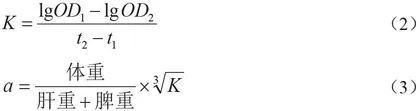
摘 要:目的:研究分析乳矿物盐与牛磺酸复合片剂的安全性与功能特性。方法:采用急性毒理学、遗传毒理学和90 d毒性试验,考察复合片剂安全性;同时,以高、中、低3个剂量组进行为期30 d的灌胃试验,分析其对小鼠体重、免疫器官指数、吞噬指数等免疫指标变化的影响。结果:毒理学试验表明对小鼠无毒副作用、无致畸、各项生理功能正常;与对照组比较,小鼠的体重与免疫器官指数均无显著的影响(P>0.05),但显著提高了小鼠的细胞免疫功能和单核巨噬细胞吞噬功能等免疫功能(P<0.05)。结论:研究表明乳矿物盐与牛磺酸复合片剂安全无毒副作用,具有增强免疫力的功能。
关键词:乳矿物盐;牛磺酸;安全性;功能性;小鼠
Abstract: Objective: Research and analyze the safety and functional characteristics of milk mineral salt and taurine compound tablets. Methods: Acute toxicology, genetic toxicology and 90-day toxicity tests were used to investigate the safety of composite tablets; at the same time, a 30-day gavage experiment was carried out in three dose groups of high, medium, and low to analyze its effects on the body weight of mice, Visceral-to-body ratio, immune organ coefficient, phagocytic index and other immune index changes. Results: The toxicology test showed that the mice had no toxic side effects, no teratogenicity, and normal physiological functions. Compared with the control group, the body weight and immune organs index of the mice had no significant effect (P>0.05), but it improved significantly. Immune functions such as phagocytosis index and anti-volume number of mice (P<0.05). Conclusion: Studies have shown that milk mineral salt compound taurine tablets are safe, non-toxic and side effects, and have the function of enhancing immunity.
Keywords: milk mineral salt; taurine; safety; functionality; mice
乳矿物盐源于牛乳,是将牛乳中天然存在的钙及矿物质盐通过膜分离技术浓缩得到含钙量较高的乳矿物质[1]。乳矿物盐不仅可补充钙,还具有降低血压、防止动脉血管狭窄等保健功能[2]。
牛磺酸一般以游离形式存在,广泛分布于哺乳动物体内,具有调节渗透压、稳定细胞膜、调节钙水平的重要功能[3]。另外,研究发现,牛磺酸具有降低血脂、改善糖尿病、抗肿瘤等活性,同时还具有较强的免疫调节作用[4]。随着对牛磺酸研究的日益深入,其已成为一种广泛用于医药、食品、保健品行业的绿色添加剂。
基于乳矿物盐与牛磺酸的功能特性,研究开发乳矿物盐与牛磺酸复合保健功能产品,用以提高特殊人群如儿童、孕产妇、老人等人群的生理功能。因此,本文以乳矿物盐与牛磺酸复合片剂为受试样品,分别进行动物安全性和功能性试验,分析受试样品对动物的安全性能和免疫功能的影响,为全面开发与利用乳矿物盐与牛磺酸复合片剂提供重要的理论指导。
1 材料与方法
1.1 材料与试剂
受试样品为乳矿物盐与牛磺酸复合片剂,每片含乳矿物盐600 mg,含牛磺酸200 mg。片剂的服用方法是每日4片。片重1.5 g/片。因此,该片剂人体每日服用6 g,即0.1 g/kg·BW(成人体重按60 kg计);军事医学科学院实验动物中心提供清洁级昆明种小鼠300只,小鼠体重16~22 g,雌雄各半,许可证号:SCXK-(军)2002-0001;饲料许可证号:清洁级,SCXK-(军)2002-018。
印度墨汁,刀豆蛋白A(ConA),细胞增殖及细胞毒性检测试剂盒(MTT),1,8-二羟基蒽醌,0.9%NaCl,NaN3,Giemsa染色,碘硝基氯化四氮唑蓝(INT),YAC-1细胞,Hank’s液(pH值为7.2~7.4),吩嗪二甲酯硫酸盐(PMS)、二甲基亚砜、台酚兰,1%壬基酚聚氧乙烯醚(NP-40),环磷酰胺(4 mg/mL),甲醇。
1.2 仪器设备
BD FACSCanto II流式细胞仪;干燥箱;倒置显微镜(OlympusIX71);打孔器(8 mm);微量血凝试验板;离心机(2-16K);酶标仪(RT-6100);培养板(96孔);CO2培养箱(Co-150);紫外可见分光光度计(UV-1800);倒置显微镜(OlympusIX71)。
1.3 试验方法
1.3.1 受试样品及配制
受试样品为乳矿物盐与牛磺酸复合片剂,0.1 g/kg·BW(成人体重以60 kg计)。以去离子水作为对照。
1.3.2 动物分组与给药
(1)功能性评价。合格证号:SCXK-(军)2002-001,体重18~22 g清洁级昆明种小鼠雌雄各100只;合格证号SCXK-(军)2002-018饲料均由军事医学科学院实验动物中心提供。饲养环境:SPF级,室温为20~22 ℃,相对湿度为(48~52)%RH,单笼喂养。试验动物随机分组,每组10只,设低、中、高3个剂量组,分别为0.5 g/kg·BW、1.0 g/kg·BW、3.0 g/kg·BW,每天定点灌胃(早10:00),连续灌胃30 d后进行试验。
(2)安全性评价。①急毒试验:同功能性试验小鼠20只,且相同饲养条件。受试样品剂量设计为20 g/kg·BW,一天两次定点灌胃(早晚10:00),连续灌胃14 d,观察小鼠体征与死亡情况。②遗传毒性试验:试验小鼠75只,且相同饲养条件,群笼饲养,5只/笼;受试样品剂量设计分别为2.5 g/kg·BW、5.0 g/kg·BW、10 g/kg·BW。阳性组:环磷酰胺4 mg/mL,每天定点灌胃(早10:00)。灌胃后正常饮食,根据试验需要观察一定时间,分别进行试验。③90 d经口毒性试验:清洁级昆明种大鼠40只,体重65~79 g,雌性各半,随机分成4组、每组10只。设低、中、高3个试验组,且受试样品的剂量分别为2.5 g/kg·BW、5.0 g/kg·BW、10.0 g/kg·BW,以去离子水为对照。试验条件:室温为19~24 ℃,湿度(40~55)%RH,单笼,每天定点灌胃(早10:00),连续灌胃90 d,自由进食饮水,每周记录1次体重和2次食物摄入量以及饲料撒漏量。灌胃结束后进行病例学检查,包括肝、脾、肾、胃肠、卵巢及睾丸。
1.3.3 功能性实验评价
(1)小鼠体重的测定。连续灌胃30 d,称量小鼠的初始和终期体重。
(2)免疫器官指数测定。参考张勇[4]的试验方法。小鼠适应饲养环境3 d后,随机分为对照组、高剂量组、中剂量组、低剂量组,每组各10只。在乳矿物盐与牛磺酸复合片剂连续灌胃30 d并于末次灌胃12 h后,将小鼠脱颈椎处死,称重,取腹腔液,并在无菌条件下分离称重肝脏和脾脏。免疫器官指数计算公式为:
免疫器官指数=免疫器官重量/体重×100%
(3)单核-巨噬功能测定。①碳廓清试验。受试样品末次灌胃12 h后,分别在注射印度墨水2 min、10 min后,迅速取20 µL的内眦静脉丛血,并与0.1% 2 mL Na2CO3溶液混合,于600 nm处测定吸光度值。同时脱颈椎处死小鼠,称重肝脏、脾脏。吞噬指数a计算公式为:
式中:K-吞噬速率;OD1-2 min时的吸光度值;OD2-10 min时的吸光度值;t1-2 min;t2-10 min;a-吞噬指数。②腹腔巨噬鸡红细胞试验。在小鼠腹腔内注射1 mL 20%鸡红细胞30 min后,将小鼠颈椎脱臼处死并固定在鼠板上,剪开腹壁皮肤并注入2 mL的生理盐水,持续1 min转动鼠板,然后在2片载玻片滴上腹腔洗液,在37 ℃的条件下温育30 min。对载玻片进行漂洗、固定、染色、蒸馏水漂洗晾干及计数等操作处理。吞噬率和吞噬指数α计算公式为:
吞噬率=吞噬细菌的细胞数/计数的细胞数×100%(4)
吞噬指数α=(100个吞噬细胞吞噬的细菌总数)/100(5)
(4)细胞免疫功能测定。①ConA诱导的小鼠淋巴细胞转化试验,按照杨迪[5]的试验方法。②迟发型变态试验。受试样品末次灌胃12 h后,将50 µL的DNFB均匀涂抹于3 cm×3 cm脱毛的腹部皮肤;5 d后,在小鼠的右耳涂抹10 µL的DNFB溶液,涂抹处理24 h后,取直径8 mm的左右耳片称重[6],左右耳肿胀度差计算公式为:
左右耳肿胀度差=右耳重量-左耳重量(6)
1.3.4 安全性评价
(1)急性经口毒性试验。试验动物适应性喂养3 d,选健康成年小鼠20只,雌雄各半,剂量设计为20 g/kg·BW,每天定点灌胃(早10:00),一天灌胃2次。正常饮食14 d后,观察记录实验动物体征变化。
(2)遗传毒性试验。①小鼠骨髓细胞微核试验。小鼠适应环境3 d,选50只健康小鼠,随机分为5组,每组10只,雌雄各半,设低、中、高3个试验组,每组受试样品剂量分别为2.5 g/kg·BW、5.0 g/kg·BW、10 g/kg·BW,另设去离子水阴性对照组及环磷酰胺阳性对照组,采用两次给药,间隔24 h,于末次给药12 h后,取胸骨制片、固定、染色,油镜下观察1 000个PCE细胞,计算微核细胞率。②精子畸形试验。动物适应环境3 d,选用25只健康雄性小鼠,随机分为5组,每组5只,设低、中、高3个试验组,每组受试样品剂量分别为2.5 g/kg·BW、5.0 g/kg·BW、10 g/kg·BW,阳性对照为4 mg/mL的环磷酰胺注射液,阴性对照组为去离子水。试验组及阴性对照组均经口灌胃。于首次给受试物后的第35 d处死小鼠,取附睾制片、染色,于油镜下对每只动物计数1 000条精子,计算精子畸形发生率,采用卡方检验进行统计。
(3)90 d经口毒性试验。对选取的试验组的大鼠连续灌胃90 d,进行病理组织学检查。
1.4 数据处理
所有试验均采用3次平行试验。单因素方差分析采用SPSS软件。分别采用LSD法和Tamnane法统计分析方差齐性分析与方差不齐统计分析。统计学显著为概率值P≤0.05。
2 结果与分析
2.1 乳矿物盐与牛磺酸复合片剂对小鼠体重影响的分析