三种马鲛鱼快速检测方法的建立及应用
作者: 杨健琪 李昂 柳淑芳
摘 要:为了准确快速鉴定马鲛鱼样品,本研究分别以线粒体Cytb和D-loop为靶基因,筛选出康氏马鲛、蓝点马鲛与斑点马鲛的特异性PCR扩增引物,建立了3种马鲛鱼的快速检测方法,并对检测方法的特异性、重复性和灵敏性进行了验证,随后运用该方法对市售马鲛鱼及其加工制品进行检测。结果表明,马鲛鱼的快速检测方法具有良好的特异性和重复性,灵敏性检测限低于2.000 ng·µL-1 DNA,运用该方法能快速检测出原料及加工产品中的马鲛鱼成分,整个过程最短用时2 h。本研究建立的3种马鲛鱼PCR快速检测方法,可实现马鲛鱼物种鉴定,满足日常检测需求,对防止水产品掺假、维护消费者权益、规范市场秩序具有重要意义。
关键词:聚合酶链式反应(PCR);马鲛鱼;快速检测;物种鉴定
The Establishment and Application of Rapid Detection Methods for Three Species of Mackerel
YANG Jianqi1,2, LI Ang2, LIU Shufang2*
(1.College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China; 2.Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China)
Abstract: To accurately and swiftly identify samples of Scomberomorus species, this study utilized mitochondrial Cytb and D-loop as target genes to screen specific PCR primers for Scomberomorus commerson, Scomberomorus niphonius, Scomberomorus guttatus, the rapid detection methods for three types of Scomberomorus were established, and the specificity, repeatability, and sensitivity of the detection methods were validated, subsequently, this method was used to detect commercially available Scomberomorus and its processed products. The results indicate that the rapid detection method for Scomberomorus exhibits excellent specificity and repeatability, the sensitivity detection limit is below 2.000 ng·µL-1 of DNA, using this method allows for the rapid detection of Scomberomorus components in raw materials and processed products, with the entire process taking a minimum of 2 h. The three rapid PCR detection methods for Scomberomorus established in this study enable the identification of Scomberomorus species, meeting the requirements for routine testing, this is of significant importance in preventing adulteration in aquatic products, safeguarding consumer rights and interests, and regulating market order.
Keywords: polymerase chain reaction(PCR); mackerel; rapid detection; species identification
马鲛鱼(Scomberomorus)为脊椎动物门(Vertebrata)硬骨鱼纲(Osteichthyes)鲈形目(Perciformes)鲭科(Scombrida)鲅属鱼类总称,别名鲅鱼,是世界范围内重要的海洋经济鱼类。我国有康氏马鲛(Scomberomorus commerson)、蓝点马鲛(Scomberomorus niphonius)、斑点马鲛(Scomberomorus guttatus)、中华马鲛(Scomberomorus sinensis)和朝鲜马鲛(Scomberomorus koreanus)5个种,广泛分布在渤海、黄海、东海和南海地区。其中,康氏马鲛、蓝点马鲛和斑点马鲛的产量较高,是我国近海主要经济物种。马鲛鱼的典型形态特征是体呈纺锤形或长纺锤形,体背侧蓝黑色,腹侧银白色,体侧有多列黑色圆斑[1-2]。因种间形态学差异较小,给物种鉴定带来一定困难。且市场上的马鲛鱼多以鲜食烹制、速冻整鱼或切片、烟熏、鱼糜制品等形式销售[3-4],通过形态学方法鉴别物种比较困难。一些不法商贩为牟取更大的利润,常用形态相似、低价值的鲐、圆鮀鲣等鱼类替代高价值马鲛鱼售卖。因此,迫切需要建立一种快速特异的检测手段对马鲛鱼进行有效鉴别。
基于聚合酶链式反应(Polymerase Chain Reaction,PCR)技术的分子生物检测方法具有特异性强、灵敏度高、不受组织类别限制等优点,更适合鱼类及其冷冻切片产品或深加工制品的物种鉴别[5-9]。为有效区分和鉴定马鲛鱼,本研究拟针对每个物种设计特异性引物,根据琼脂糖凝胶电泳图的条带有无和PCR产物长度即可实现物种的准确快速分类和鉴定。
1 材料与方法
1.1 材料
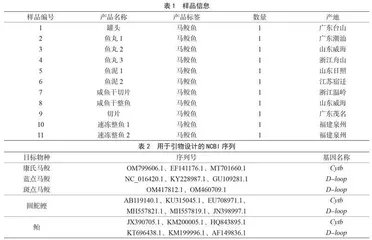
康氏马鲛(S. commerson)、斑点马鲛(S. guttatus)、蓝点马鲛(S. niphonius)各3条,取自国家海洋渔业生物种质资源库的渔业生物DNA条形码凭证标本库,用于建立3种鱼类的特异性检测方法。同时,从购物平台采购了不同产地马鲛鱼的鱼片、鱼丸、鱼泥、鱼干和鱼罐头等制品,如表1所示,用于马鲛鱼快速检测方法的验证。
1.2 实验方法
1.2.1 DNA提取
本实验采用天根生物科技有限公司的海洋生物组织基因组DNA提取试剂盒提取DNA。将提取好的DNA置于-20 ℃保存,待后续PCR扩增使用。
1.2.2 PCR引物设计
通过NCBI数据库搜索并下载康氏马鲛、斑点马鲛、蓝点马鲛、圆鮀鲣和鲐的线粒体基因序列,如表2所示,使用MEGA7.0软件进行序列比对,找出Cytb和D-loop序列的变异区域。
使用Primer Premier 5.0软件在种间高度变异而种内高度保守的区域设计12对特异性引物。先在NCBI数据库中使用primer-BLAST工具进行引物特异性筛选,获得3对特异性高的引物。然后使用康氏马鲛、蓝点马鲛和斑点马鲛凭证标本对引物的特异性进行检验。最终筛选出的特异性引物序列如表3所示。引物由青岛华大基因公司合成。
1.2.3 PCR反应体系和条件
PCR反应体系为25 µL,包含Taq混合液(2×)12.5 µL,DNA模板3 µL,引物(10 µmol·L-1)各1 µL,无菌双蒸水7.5 µL。
康氏马鲛的PCR反应条件为94 ℃预变性5 min;94 ℃变性30 s;59 ℃退火30 s;72 ℃延伸20 s,共30个循环;72 ℃延伸5 min。蓝点马鲛和斑点马鲛的反应条件与康氏马鲛的PCR反应条件相同,仅退火温度不同。蓝点马鲛退火温度设定为61 ℃,斑点马鲛退火温度设定为58 ℃。
1.2.4 PCR扩增产物电泳检测
使用质量浓度为1%的琼脂糖凝胶电泳检测PCR扩增产物,电压为120 V,电泳10~15 min。根据电泳条带的有无和扩增产物片段大小,判断待样品是否为目标鱼类。
1.2.5 特异性检测
为验证3种马鲛鱼引物特异性,分别以目标鱼类为试验组,其他近缘物种为阴性对照组,以无菌双蒸水为模板作空白对照,进行3个平行的PCR试验。由于生物体往往存在个体差异性,将目标物种进行
3个不同个体的生物学重复检测,每组以其中一种马鲛鱼的3个不同个体为阳性对照,其余两种马鲛鱼、圆鮀鲣及鲐的3个不同个体为阴性对照,以无菌双蒸水作为空白对照。
1.2.6 灵敏度检测
将提取的康氏马鲛、斑点马鲛、蓝点马鲛DNA进行10倍连续梯度稀释,稀释后的浓度分别为20.000 ng·µL-1、2.000 ng·µL-1、0.200 ng·µL-1、0.020 ng·µL-1、0.002 ng·µL-1,依次进行各浓度DNA样品的PCR试验,以考察所建立方法的检测灵敏度。
2 结果与分析
2.1 检测方法的特异性和重复性
蓝点马鲛特异性引物检测结果如图1所示,本研究设计的特异性引物仅能够扩增出蓝点马鲛的基因片段,扩增长度符合目标片段长度,在其他物种中未出现非特异性扩增。因此,本研究设计的特异引物对蓝点马鲛具有特异性。
泳道:01为蓝点马鲛;02为斑点马鲛;03为康氏马鲛;04为圆鮀鲣;05为鲐;06~07为空白;08为Marker。
蓝点马鲛特异性引物重复检测结果如图2所示,01~03为蓝点马鲛阳性结果,基于蓝点马鲛D-loop基因设计的特异性引物能够扩增出3个蓝点马鲛样品的D-loop基因片段,扩增长度均符合目标片段长度,不出现其他非特异性扩增片段。
斑点马鲛特异性引物检测结果如图3所示,02为斑点马鲛阳性结果,基于斑点马鲛D-loop基因设计的特异性引物能够扩增斑点马鲛的D-loop基因片段,扩增长度符合目标片段长度,不出现其他非特异性扩增片段。因此,本研究设计的斑点马鲛特异引物对斑点马鲛具有特异性。
斑点马鲛特异性引物重复检测结果如图4所示,04~06为斑点马鲛阳性结果,基于斑点马鲛D-loop基因设计的特异性引物能够扩增出3个斑点马鲛样品的D-loop基因片段,扩增长度均符合目标片段长度,不出现其他非特异性扩增片段。
泳道:01~03为蓝点马鲛;04~06为斑点马鲛;07~09为康氏马鲛;10~12为圆鮀鲣;13~15为鲐;16为空白;17为Marker。
康氏马鲛特异性引物检测结果如图5所示,03为康氏马鲛阳性结果,基于康氏马鲛Cytb基因设计的特异性引物能够扩增康氏马鲛的Cytb基因片段,扩增长度符合目标片段长度,不出现其他非特异性扩增片段。因此,本研究设计的康氏马鲛特异引物对康氏马鲛具有特异性。
康氏马鲛特异性引物重复检测结果如图6所示,01~03为康氏马鲛阳性结果,基于康氏马鲛Cytb基因设计的特异性引物能够扩增出3个康氏马鲛样品的Cytb基因片段,扩增长度均符合目标片段长度,不出现其他非特异性扩增片段。
泳道:01~03为康氏马鲛;04~06为斑点马鲛;07~09为蓝点马鲛;10~12为圆鮀鲣;13为鲐;16为空白;17为Marker。