复合蛋白粉安全性和免疫功能评价
作者: 史雅玮 田亚超 周麟依
摘 要:本研究旨在评估复合蛋白粉(Complex Protein Powder,CPP)的安全性和免疫功能。急性经口毒性实验、遗传毒性实验和亚急性口服毒性实验(28 d)结果显示,CPP安全性较高,不会对小鼠的生长发育产生负面影响。CPP对小鼠免疫功能的影响试验显示,中剂量组(1 667 mg·kg-1 bw·d-1)CPP可以显著提升小鼠的NK细胞活性、巨噬细胞吞噬率等指标,有效增强小鼠的免疫功能。
关键词:乳清蛋白粉;大豆分离蛋白;复配蛋白粉;安全性;免疫功能评价
Evaluation of Safety and Immune Function of Complex Protein Powder
SHI Yawei1, TIAN Yachao2, ZHOU Linyi3*
(1.National Agricultural Science and Technology Park Management Committee of Jiansanjiang in Heilongjiang Province, Jiamusi 156399, China; 2.School of Food Science, Qilu University of Technology, Jinan 250300, China; 3.School of Food and Health, Beijing Technology and Business University, Beijing 100048, China)
Abstract: This study aims to evaluate the safety and immune function of Complex Protein Powder (CPP). The safety of CPP was evaluated through acute oral toxicity test, genetic toxicity test and subacute oral toxicity test (28 d). The experiment on the influence of CPP on mice’s immune system revealed that a moderate dose (1 667 mg·kg-1 bw·d-1) of CPP could notably augment NK cell activity, macrophage phagocytosis rate and other markers in mice.
Keywords: whey protein powder; soy protein isolate; complex protein powder; safety; immune function evaluation
复合蛋白粉通常是由两种及两种以上不同来源的动物蛋白或植物蛋白为主要原料制备而成的粉末状产品。复合蛋白粉具有增强免疫力[1]、改善记忆力[2]、增强体质和运动能力[3]的功效,因而受到了食品加工企业以及消费者的青睐。豆粉是豆粕粉碎过筛后得到的产物,富含蛋白质、脂肪以及人体所需的营养元素,具有显著的经济效益和使用价值。
乳清蛋白是乳制品经过沉淀作用除去酪蛋白后,从上清液中提取的物质,其主要是由免疫球蛋白等功能性蛋白组成[4]。乳清蛋白作为一种优质的蛋白质补充物质,具有提高人体免疫力[5]、预防疾病[6]等功能,其常被广泛应用于复合蛋白粉中。
大豆分离蛋白属于食品工业中的重要植物蛋白,含有大量的优质蛋白质[7]。大豆分离蛋白经过消化吸收后,会形成大豆蛋白多肽,可以发挥出抗疲劳、降血糖、增强免疫力等作用。此外,研究发现大豆蛋白还具有预防肥胖[8]、增强体质[9]、增强免疫力[10]等保健作用。
大豆蛋白及大豆分离蛋白、乳清蛋白和维生素C在各种保健食品较为常见,但将植物蛋白、动物蛋白和维生素C复配后制备蛋白粉的研究较少。因此本研究通过急性毒性试验、遗传毒性试验、28 d经口毒性试验和免疫功能试验对CPP的安全性和功能进行评估,为进一步开发和利用复配蛋白产品提供了科学依据。
1 材料与方法
1.1 试剂与仪器
1.1.1 实验材料
受试样品为混合蛋白粉,每份含豆粉3 g,乳清蛋白粉3 g,大豆分离蛋白1 g,辅料3 g。用法用量:每日1次,每次1份,冲服,即0.167 g·kg-1 bw(成人体重按60 kg计)。试验菌株采用上海疾控中心提供的组氨酸营养缺陷型鼠伤寒沙门菌。
昆明种SPF级小鼠及SD大鼠(雌雄),由北京维通利华试验动物科技有限公司购得,经营许可证为SCXK(京)2016-0011。将实验小鼠和大鼠放于温度为(22±2)℃、湿度为55%±5%的密闭空间内,在12 h的光照-暗循环中自由饮水和进食。依据齐鲁工业大学的《实验动物管理条例》完成本试验的各项工作,且经过齐鲁工业大学动物伦理学委员批准。
1.1.2 试剂
叠氮钠从北京鼎国生物科技有限公司购得,2-乙酰氨基芴,1,8-二羟基蒽醌,环磷酰胺,敌克松和丝裂霉素C从Roche公司购得。血液分析试剂及生化试剂盒从深圳迈瑞生物医用电子有限公司购得,细菌总DNA提取试剂盒从天根生化公司购得,DNA Marker从哈尔滨海基生物技术有限公司购得。
1.1.3 仪器
电子天平,上海梅特勒-托利多仪器有限公司;高压灭菌锅,日本Panasonic公司;离心机,美国TOMOS公司;生化分析仪和血细胞分析仪,深圳迈瑞生物医疗电子股份有限公司;荧光定量仪(Qubit 3.0),美国Life Technologies公司。
1.2 实验方法
依据食品安全国家标准中毒理学评价的相关方法和经济合作与发展组织(Organisation for Economic Co-operation and Development,OECD)指南407中的相关规定,对CPP开展急性经口毒性试验、3项遗传毒性试验及28 d的亚急性口服毒理学试验的研究。
1.2.1 急性经口毒性试验
对20只实验小鼠进行研究,平均重量18~20 g,随机分为两组。在开始实验之前,必须让小鼠保持14 h的饥饿状态。测试物质通过无菌水调和到每毫升含有1 g的悬浮溶液中,每公斤体重摄入体积为20 mL,从给药到结束共14 d,在此期间定时观察小鼠的健康情况、出现的中毒迹象及其死亡比例。
1.2.2 遗传毒性试验
(1)骨髓细胞微核试验。按照小鼠精母细胞染色体畸变实验的要求,当急性毒性实验得不到LD50时,高剂量组以10.0 g·kg-1 bw为宜。从体重在18~22 g的小鼠中,选择50只进行实验。小鼠雌雄各25只,雌性小鼠和雄性小鼠各随机分成5组。阴性对照组给予无菌水;剂量组使用水作为溶剂,分别以2.5 g·kg-1 bw、5.0 g·kg-1 bw和10.0 g·kg-1 bw的剂量给予药物;阳性对照组则使用环磷酰胺(40 mg·kg-1)。每只小鼠的灌胃容量为200 μL/10 g bw,每隔24 h进行1次,最后1次灌胃后等待6 h后,进行骨髓涂片并染色观察。共观察和统计每只小鼠(嗜多染红+正染红)骨髓中的1 000个血淋巴细胞,并记录所观察到的成熟红细胞数,计算未成熟红细胞与成熟红细胞的比值(PCE/NCE)。
(2)精子畸形试验。将25只体重为(20±2)g的雄性小鼠随机分成5组,其中剂量组的小鼠使用溶剂为水,剂量分别为2.5 g·kg-1 bw(低)、5.0 g·kg-1 bw(中)和10.0 g·kg-1 bw(高);阴性对照组使用无菌水,阳性对照组使用环磷酰胺(剂量为40 mg·kg-1 bw),每天灌胃容量为200 μL/10 g bw,持续5 d。在首次灌胃后35 d,将小鼠处死,取下两侧副睾丸,制作精液涂片,进行形态学观察,并记录畸形精子的数量。
1.2.3 28 d经口毒性试验
将80只体重为80~100 g的SD大鼠,分为阴性组、对照组和剂量组。剂量组分别进行0.167 g·kg-1(低)、1.670 g·kg-1(中)和16.700 g·kg-1(高)的剂量处理。大鼠自由进食,每天摄取量为100 g·kg-1 bw。
通过大鼠脏器指数评估样品的28 d经口急性毒性。在解剖之前,对大鼠进行称重,在解剖之后,摘取它们的各种器官,用无菌生理盐水清洗表面,再用滤纸将它们吸干,然后快速称重,称重后,再用肉眼进行尸检,脏体比=脏器重量/体重×100%。
1.2.4 小鼠免疫功能检测
SPF级昆明种小鼠160只,体重为(20±2)g,分为4组。第1组和第2组均为雌性小鼠,每组有40只。第1组用于进行迟发型变态反应(Delayed Type Hypersensitivity,DTH)试验,而第2组用于小鼠碳廓清试验。第3组和第4组均为雄性小鼠,每组有40只。第3组用于巨噬细胞吞噬试验,而第4组用于测定NK细胞活性。每个免疫组又分为对照组和剂量组(共3个剂量组)。根据成人每日推荐摄入量(166.7 mg·kg-1 bw·d-1),设定低剂量组(833 mg·kg-1 bw·d-1)、中剂量组(1667 mg·kg-1 bw·d-1)、高剂量组(5 001 mg·kg-1 bw·d-1)。灌胃,每次用量20 g·kg-1。对照组用纯水代替,灌胃30 d后测定免疫指标。
1.3 统计与分析
使用SPSS 20.0对本文数据进行处理,计量数据使用单因素方差分析,计数数据使用非参数检验,P<0.05表示差异具有统计学显著性。
2 结果与分析
2.1 急性经口毒性试验
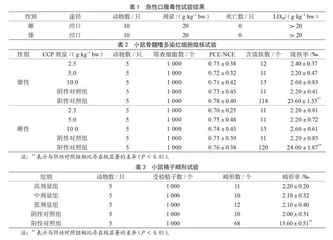
由表1可知,实验大鼠灌胃CPP溶液后,食量、皮肤颜色、活动均正常,无明显的毒性反应。结果表明,CPP对雄性和雌性大鼠的经口LD50均高于20 g·kg-1 bw,按照急性毒性的剂量分级标准(GB/T 35823—2018)判定CPP为无毒级物质。
2.2 遗传毒性试验
2.2.1 骨髓细胞微核试验
由表2可知,所有实验小组的小鼠PCE/NCE都在正常的范围之内(0.70~0.78),这证明了CCP对生物体没有明显的致死作用。与阴性对照组相比,不同剂量CPP的微核比率并无明显差别,说明CCP在测试阶段的安全性能良好且并未导致动物体内细胞发生异常变化。
2.2.2 小鼠精子畸形试验
由表3可知,阴性对照组的精子畸形率是2.00‰。与阴性对照组相比,高、中、低剂量组均无明显的差别(P>0.05)。阳性对照组小鼠精子的畸形率为13.60‰。相较于阴性对照组,阳性对照组有显著不同(P<0.01)。实验结果表明CPP对于小鼠精子没有明确的导致畸形的效用。
2.3 28 d亚急性口服毒理学试验
在动物的安全评估实验中,脏体比是一个常用的衡量标准,它可以揭示被测试物质对于生物组织的损害情况。由表4可知,剂量组和对照组之间,心脏、肝脏、脾脏、肺部和肾脏等器官的脏体比并没有显著差异(P>0.05),说明CPP不会对大鼠的各脏器造成损伤。
2.4 小鼠免疫功能试验分析
通过DTH试验、小鼠廓清试验、巨噬细胞吞噬试验、NK细胞活性试验等评价小鼠的细胞免疫功能,试验结果见表5。与对照组相比,中剂量组CPP能显著增强小鼠耳廓肿胀度、廓清试验吞噬指数、巨噬细胞吞噬率、巨噬细胞吞噬指数以及NK细胞活力,高剂量组CPP能显著增强小鼠的耳廓肿胀度、廓清试验吞噬指数,说明中剂量组CPP能够显著增强小鼠的免疫功能。