浅析生活饮用水中水质微生物检测能力验证的结果与质量控制
作者: 徐新龙 杨杰 李玉龙 李兰 莫善明 刘佳丽
摘 要:生活饮用水中的微生物指标是判定水质安全合格与否的重要指标之一,提升实验室生活饮用水中水质微生物项目的检测能力,可为海关执法和政策制定提供科学依据。本文依据GB/T 5750.12—2006中微生物指标检验方法和本次能力验证计划的参试作业指导书要求,采用平皿计数法对样品1#、2#中菌落总数进行检测,采用多管发酵法对样品3#、4#中的总大肠菌群、耐热大肠菌群和大肠埃希氏菌进行检测。结果显示,4项检验项目的|Z|≤2,获得“满意”结果。通过参加该能力验证计划项目,分析与总结了能力验证检测过程中的注意事项与质量控制要求,有效评价了实验室操作人员的检测能力水平。
关键词:生活饮用水;菌落总数;大肠菌群;能力验证;质量控制
Abstract: The microbial index of domestic drinking water is one of the important indicators to determine whether the water quality is safe or not. Improving the detection ability of the laboratory’s microbial project of domestic drinking water quality can provide a scientific basis for customs law enforcement and policy formulation. In accordance with the requirements of GB/T 5750.12—2006 microbial index test method and the operation instruction for participation in this capacity verification plan, this paper uses the plate counting method to detect the total number of colonies in sample 1# and 2#, and uses the multi tube fermentation method to detect the total coliform, heat resistant coliform and Escherichia coli in sample 3# and 4#. The results showed that |Z|≤2 of the 4 inspection items obtained a “satisfactory” result. By participating in the proficiency testing program, the precautions and quality control requirements during the proficiency testing process were analyzed and summarized, and the testing ability level of laboratory operators was effectively evaluated.
Keywords: drinking water; total number of colonies; total coliform; proficiency testing; quality control
水是不可或缺的宝贵自然资源,自然界中的水往往含有各类杂质及多种微生物,如果直接饮用,将会导致机体遭受不同程度的破坏,从而引发各种类型的疾病,严重时可危及生命[1]。微生物群是水是否被污染的重要指示物,可将生活饮用水和水源水中的微生物,如大肠菌群等检验结果作为判断水质合格与否,以及水传染病流行的预警信息[2]。菌落总数、大肠菌群、铜绿假单胞菌等是生活饮用水中的主要微生物指标,可根据《生活饮用水标准检验方法 微生物指标》(GB/T 5750.12—2006)规定的检测方法及其他标准开展检验[3]。
能力验证是指利用实验室间比对,并按照预先制定的准则评价参加者的能力[4]。它是判断和监控实验室能力、并使实验室质量管理体系有效性与效率得到持续改进与不断提高的重要途径,经常被应用于实验室的外部质量控制活动中,其结果可用于新建方法的证实、人员数据分析能力的培养、人员检测能力考核、设备操作及管理等[5]。阿拉山口海关技术中心动植食品纺织实验室严格按《能力验证领域和频次表》(CNAS—AL 07:2015)规定[6],每年都积极参加国内外食品微生物领域能力验证活动,稳步提升了该实验室的微生物检测能力与水平。
1 材料与方法
1.1 测试样品及标准菌株
待检测样品为4份西林瓶真空包装的白色块状冻干粉末,菌落总数样品检测标识1#、2#,总大肠菌群、耐热大肠菌群及大肠埃希菌样品检测标识3#、4#:中国检验检疫科学研究院测试评价中心;大肠埃希氏菌(ATCC 25922),上海宝录科技有限公司。
1.2 试剂及培养基
营养琼脂(Nutrient Agar,NA);乳糖蛋白胨;伊红美蓝琼脂(Eosin Methylene Blue Agar,EMB);革兰氏染色液;EC培养基;EC-MUG培养基,北京陆桥公司。
1.3 仪器与设备
SPX-160生化培养箱(宁波江南仪器厂);CL-40M高压灭菌器(日本ALP公司);NU-404-400E生物安全柜(美国NUAIRE公司);HH.S21-4电热恒温水浴锅(上海博迅);Eclipse Ci-L显微镜(日本尼康公司)。
1.4 检验方法
按照参试能力验证作业指导书与实验室获认可方法《生活饮用水标准检验方法 微生物指标》(GB/T 5750.12—2006)进行检测。
1.4.1 样品再水化
依据指导书用220 mL无菌水对参试样品进行再水化。取出4 ℃低温冷藏样品,待其温度与室温达到平衡后,在生物安全柜内开启装有样品1#、2#的西林瓶,先加入无菌水10 mL,待冻干粉完全溶解后,将其吸出并移至另一无菌瓶中,加无菌水反复润洗西林瓶的内表面,回收清洗液至无菌瓶内,最后充分混匀,此溶液即等同于220 mL的待测生活饮用水样品原液。样品3#、4#处理方法同前述,但需将再水化加入无菌水体积改为20 mL。
1.4.2 菌落总数检测方法
将样品1#、2#用MS3涡旋混匀器充分混匀,再用一次性无菌移液管吸取该原液各1 mL,分别注入直径9 cm的一次性无菌培养皿中,将121 ℃高压灭菌后的营养琼脂冷却至45 ℃左右,倾注至培养皿的低刻度线处,即约15 mL,旋紧摇匀,保证二者充分混匀,同法接种平行样品培养皿。无菌吸取1 mL待测水样置于9 mL灭菌生理盐水管中,充分混匀制成1∶10(V∶V)稀释液,吸取1 mL 1∶10(V∶V)稀释液注入9 mL灭菌生理盐水管中,混匀即得1∶100(V∶V)稀释液,同上连续梯度稀释制成1∶1 000(V∶V)稀释液,接种方法同上,另取空白培养皿加入营养琼脂作为空白对照。待所有平皿凝固后,将其倒置于生化培养箱内36 ℃培养48 h后计数菌落数。
1.4.3 总大肠菌群乳糖发酵试验
多管发酵法:取10.0 mL样品3#、4# 分别接种含10 mL双料乳糖蛋白胨溶液的试管5支;取1 mL样品3#、4#分别接种含10 mL单料乳糖蛋白胨溶液的试管5支;取1.0 mL样品3#、4#加至含9 mL灭菌生理盐水的管中,吸取混匀后的液体1.0 mL(即0.1 mL),分别接种含10 mL单料乳糖蛋白胨溶液的试管5支,所有试管内均置有小倒置管。接种完毕后置于36 ℃生化培养箱培养24 h。将发酵后产酸产气的阳性管分别在伊红美蓝平板上做连续划线法接种,36 ℃培养24 h培养后,观察其菌落形态,革兰氏染色与镜检后进行进一步复发酵证实实验。
1.4.4 耐热大肠菌群检测
采用多管发酵法检测水中耐热大肠菌群。总大肠菌群产酸产气阳性者,用接种环挑取一环管中液体,接种EC培养基管,置于恒温水浴槽中44.5 ℃培养24 h,同时接种伊红美蓝琼脂平板,于44.5 ℃培养24 h,具有典型菌落形态的样品则证实为阳性。
1.4.5 多管发酵法检测水中大肠埃希氏菌检测
采用多管发酵法检测水中大肠埃希氏菌。用接种环挑取经证实为总大肠菌群阳性试管中的液体,接种到EC-MUG管中,置于恒温水浴槽中44.5 ℃培养24 h,将培养完毕后的EC-MUG管放在暗处用紫外灯照射(波长336 nm,功率6 W)观察,有蓝色荧光的样品则为阳性。
2 结果与分析
2.1 菌落总数结果
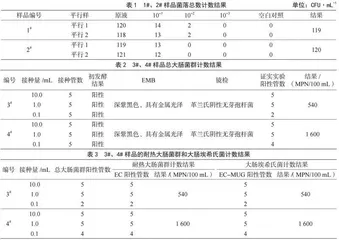
菌落总数计数结果与被检样品的稀释度倍数成反比,且同一样品稀释度的两个平行样之间差异越小,表明实验结果相对准确;空白对照无菌落生长,则表明实验过程无污染,实验条件成立,结果有效[7]。在实验过程中为确保有适宜的稀释度在可计数范围内,实验选取了原液、10-1、10-2、10-3 4个稀释度,参试样品的平行样一和平行样二分别计数菌落总数,选二者平均值作为最终报告数,结果见表1。最终报告1#样品的菌落总数为119 CFU·mL-1,2#样品的菌落总数为120 CFU·mL-1。
2.2 总大肠菌群检测结果
总大肠菌群多管发酵法检测结果见表2。从表2可以看出,样品3#、4#经初发酵实验后,部分试管变黄变混浊,内置倒置管中出现气泡,或出现絮状沉淀,均带有粪臭味。用伊红美蓝琼脂平板将初发酵阳性管划线培养后,呈深紫黑色、圆形的典型菌落,略微带有金属光泽,染色及镜检为革兰氏阴性(G-)、两端钝圆、无芽孢杆菌。经查表最终报告为3#样品的总大肠菌群数为540 MPN/100 mL,4#样品的总大肠菌群数为1 600 MPN/100 mL。
2.3 耐热大肠菌群及大肠埃希氏菌计数结果
耐热大肠菌群及大肠埃希氏菌多管发酵法检测结果见表3。由表3可以看出,将经总大肠菌群证实实验确定的阳性管转种EC发酵管后均产酸产气,转种EMB平板后均出现典型菌落生长;将上述阳性管再接种EC-MUG管后也均产生蓝色荧光。经查表最终报告为3#样品的耐热大肠菌群和大肠埃希氏菌计数结果为540 MPN/100 mL,4#的耐热大肠菌群和大肠埃希氏菌计数结果为1 600 MPN/100 mL。
2.4 能力验证结果与分析
依据此次能力验证提供者反馈的|Z|值对结果进行评价,|Z|值≤2.0为满意结果,2.0<|Z|值<3.0为可疑结果,|Z|值≥3.0为离群结果[8]。如表4所示,实验室此次上报能力验证结果的|Z|值均<2.0,并且|Z|值相对都较小,评价结果均为结果满意。
3 结论与讨论
综上所述,实验室参加本次CNAS能力验证提供者组织的生活饮用水中菌落总数,以及总大肠菌群、耐热大肠菌群、大肠埃希氏菌能力验证计划,4项参数的|Z|值均≤2.0,取得满意结果。此次能力验证项目均属定量检验,需报送具体参数,相较于定性检验来说,具有一定难度。近年来,微生物检测领域检测能力验证项目的难度不断增大,检测周期安排也更为紧凑,除前期准备及结果报告的时间,基本仅留有完成一次完整检测周期的时间,不容复测。这就需要操作人员认真对待每一次能力验证,提前做好各项准备,合理优化检验流程,并对检测过程中的各类影响因素进行必要的质量控制。