低温乳制品中沙门氏菌实时荧光PCR检测方法体系的建立
作者: 陶文靖 赵婷婷 王琦 董彬 王玉花 王维嘉 刘赫东 曲连海
摘 要:低温乳制品保质期短,对运输、储存条件要求较高,如果储存温度未达到要求,就会增加微生物增殖的风险。沙门氏菌作为乳制品必检项目需要重点关注,但现有国家标准检测方法操作较烦琐,耗时长,无法满足快速检测需求;国内现行有效的沙门氏菌实时荧光聚合酶链式反应(Polymerase Chain Reaction,PCR)行业标准方法,操作环节复杂,对人员操作要求较高。本研究通过优化增菌培养基以及实时荧光PCR方法,建立了一套更严格、简单、适合企业操作的沙门氏菌实时荧光PCR方法体系,并经过科学的验证评价,以满足低温乳制品生产加工过程及终产品快速放行、及时纠偏的需求,提高致病菌检测技术能力,降低食品安全风险。
关键词:低温乳制品;沙门氏菌;实时荧光PCR;方法评价
Establishment of a Real-time Fluorescent PCR Method for Detection of Salmonella in Low Temperature Dairy Products
TAO Wenjing1, ZHAO Tingting2, WANG Qi3, DONG Bin4, WANG Yuhua3, WANG Weijia5, LIU Hedong1, QU Lianhai1*
(1.Beijing Meizheng Bio-Tech Co., Ltd., Beijing 102200, China;
2.Bright Dairy Co., Ltd., East China Center Factory, Shanghai 201111, China;
3.SGS-CSTC Standards Technical Services (Qingdao) Co., Ltd., Qingdao 266071, China;
4.Tianjin Bright & Mengde Dairy Co., Ltd., Tianjing 300499, China;
5.Wuhan Branch, SGS-CSTC Standards Technical Services Co., Ltd., Wuhan 430056, China)
Abstract: Low temperature dairy products have short shelf life and high requirements for transportation and storage conditions. If the storage temperature does not meet the requirements, it will increase the risk of microbial proliferation. Salmonella, as a mandatory item of dairy products, needs special attention, but the existing national standard detection methods are cumbersome and time-consuming, and can not meet the needs of rapid detection; The current effective Salmonella real-time fluorescent polymerase chain reaction (PCR) industry standard method in China has complex operation links and high requirements for personnel operation. By optimizing the enrichment medium and the real-time fluorescent PCR method, this study has established a more rigorous, simple and suitable real-time fluorescent PCR method system for Salmonella for enterprise operation, which has been scientifically verified and evaluated to meet the needs of the production and processing process of low-temperature dairy products and the rapid release and timely correction of end products, improve the technical ability of pathogenic bacteria detection, and reduce food safety risks.
Keywords: low-temperature dairy products; Salmonella; real-time fluorescence PCR; method evaluation
近年来,我国居民对营养健康的关注度越来越高,对牛奶可以提升免疫力的认可度较高[1]。液态乳制品中低温鲜奶以“更新鲜、更营养”的特点受到消费者的青睐。《2020中国奶商指数报告》显示,96.0%的中国消费者认为低温鲜奶富含乳铁蛋白和免疫球蛋白等活性因子,能有效提升机体免疫力[2]。
近几年,国产优质低温巴氏杀菌乳的灭菌温度已由105 ℃降低到75 ℃,乳中含有的乳铁蛋白、免疫球蛋白、过氧化物酶等对人体有益的活性成分得到最大限度的保留,可以达到进口乳制品的8倍[3-4]。这种杀菌工艺杀灭了大部分微生物,允许残留部分微生物,将微生物含量降低到不会威胁人体健康的程度[5]。低温乳制品保质期短,根据包装形式的不同,在2~6 ℃条件下,巴氏杀菌乳保质期一般为2~7 d,低温酸奶保质期一般为14~21 d[6]。巴氏杀菌乳对运输、储存条件要求较高,一旦储存温度达不到要求,可能会存在微生物增殖的风险[7]。食源性致病菌是引起食品安全问题的主要因素之一,而微生物污染是导致牛奶质量问题的重要因素,因此牛奶中的致病菌成为消费者关注的焦点[8-10]。根据我国国标要求,需重点关注的致病性微生物有金黄色葡萄球菌、沙门氏菌等。
沙门氏菌(Salmonella)属于肠杆菌科革兰氏阴性需氧及兼性厌氧菌,沙门氏菌感染是引起人类食源性肠胃炎的重要病因之一[11]。沙门氏菌感染最常见于动物源食物,通过摄入动物源性受污染的食品造成的食物中毒占人类沙门氏菌病例的75%[12]。《食品安全国家标准 预包装食品中致病菌限量》(GB 29921—2021)规定,我国乳及乳制品中沙门氏菌的限量是n=5,c=0,m=0 CFU/25 g(mL);国际食品法典委员会(Codex Alimentarius Commission,CAC)对于乳制品中沙门氏菌的限量是n=15,c=0,m=0 CFU/25 g(mL),对于用于特殊食疗目的乳制品的采样方案相对严格,n=30,c=0,m=0 CFU/25 g(mL)[13];澳大利亚、新西兰、美国、韩国和英国等众多国家对沙门氏菌的限量要求也是25 g(mL)不得检出,取样量n略有差别[14]。
《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)中沙门氏菌检验流程通常为3~7 d,此标准在食品安全领域为保障人们的身体健康作出突出贡献,但操作较烦琐,耗时长,不能满足快速检测需求[15]。低温乳制品保质期较短,终成品快速放行以及流通过程中的快速监控尤为重要。2021年8月《乳制品生产许可审查细则(征求意见稿)》公开征求意见中,要求企业针对短保产品建立有效的微生物快速检测方法。
国内现行有效的沙门氏菌实时荧光聚合酶链式反应(Polymerase Chain Reaction,PCR)行业标准方法,操作环节复杂,对人员操作要求较高,需要2步增菌,时间较长[16]。本研究是要建立一套更严格、简单、适合企业操作的沙门氏菌实时荧光PCR方法,以满足低温乳制品生产加工过程及终产品快速放行、及时纠偏的需求,提高致病菌检测技术能力,降低食品安全风险。
1 材料与方法
1.1 材料与试剂
ATCC 14028鼠伤寒沙门氏菌、CICC 21498鸭沙门氏菌、CMCC(B)50071伤寒沙门氏菌、CMCC(B)50093甲型副伤寒沙门氏菌、CMCC(B)50094乙型副伤寒沙门氏菌、CMCC(B)50335肠炎沙门氏菌,标准菌株;高温杀菌乳(低温保藏);巴氏杀菌乳;发酵乳;脑心浸液培养基(Brian Heart Infusion,BHI);缓冲蛋白胨水(Buffered Peptone Water,BPW)培养基;MicroFast®沙门氏菌快速增菌培养基。
1.2 仪器与设备
PCR仪(型号为SLAN-96P,上海宏石医疗科技有限公司);匀质器(型号为BagMixer@400,Interscience);涡旋振荡器(型号为MX-S,大龙兴创实验仪器(北京)股份公司);恒温培养箱(型号为BPC-150F,LRH-250,上海一恒科学仪器有限公司);恒温摇床(型号为ZWY-240,上海智诚分析仪器制造有限公司);离心机(型号为5430R,Eppendorf);金属浴(型号为OSE-DB-01,天根生化科技有限公司)。
1.3 方法体系的选择
结合准确性、可操作性、方法趋势、整体检测时间以及成本等,最终选定的方法体系为快速增菌结合实时荧光PCR,增菌液直接进行初筛,阳性结果进一步采用国标方法进行确认。进而对方法体系进行可行性研究、优化以及方法评价,最后形成方法体系。
1.4 方法可行性研究
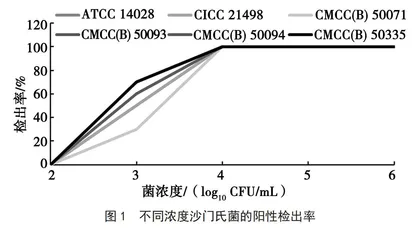
1.4.1 实时荧光PCR试剂盒灵敏度评价
取沙门氏菌培养物,用无菌水进行10倍系列梯度稀释,同时检测沙门氏菌的浓度。以不同浓度的稀释液为样本,用检测体系中的裂解液裂解后,使用PCR试剂盒进行检测,每个浓度梯度重复10次。记录不同沙门氏菌不同浓度的阳性检出率。
1.4.2 培养基的增菌效果评价
取25 g(mL)样品于225 mL MicroFast®沙门氏菌快速增菌培养基中,按照(5~10) CFU/25 g的浓度进行沙门氏菌标准菌株的添加,匀质2 min,(36±1)℃培养24 h。计数增菌后18 h和24 h的沙门氏菌浓度。
1.5 方法体系的评价
在方法系统针对目标菌沙门氏菌检测的特异性方面,使用20株目标菌和15株非目标菌验证其包容性和排他性;在方法体系针对低温乳制品的适用性方面,通过采用人工添加菌种到不同类型样品的方式,验证方法体系在灵敏度、方法准确度等方面与参考标准方法的一致性。
1.5.1 特异性验证
取沙门氏菌阳性菌株20株和非沙门氏菌15株,用无菌接种环将各菌株划线接种于BHI琼脂平板中,(37±1)℃培养18~24 h。用无菌接种环挑取单菌落,置于50 μL无菌PBS中混匀,制备成菌悬液,分别按照PCR方法体系进行检测。
1.5.2 与参考标准方法一致性验证
(1)菌悬液制备。将沙门氏菌标准菌株(鼠伤寒沙门氏菌ATCC 14028、肠炎沙门氏菌CMCC(B)50335、伤寒沙门氏菌CMCC(B)50071)和非沙门氏菌(大肠埃希氏菌ATCC 25922、福氏志贺氏菌CMCC(B)51572、铜绿假单胞菌ATCC 27853)用无菌接种环分别划线接种于BHI琼脂平板上,(37±1)℃培养18~24 h。用无菌接种环挑取单菌落,接种于BHI液体培养基,恒温摇床(37±1)℃,160 r/min,振摇培养18 h。用平板计数琼脂培养基计数菌液浓度,并用无菌PBS培养基制备10倍梯度稀释液。
(2)人工添加样品制备。取高温杀菌乳(低温保藏)、巴氏杀菌乳、发酵乳各60个,每个样品称取2份各25 g,其中一份按照方法体系加入225 mL沙门氏菌增菌培养基,另一份加入GB 4789.4—2016中的稀释液缓冲蛋白胨水(BPW),发酵乳样品使用无菌1 mol/L NaOH调节pH值至7.0±0.5。分别同时添加目标菌和非目标菌,制备成阴性控制样品54个(目标菌浓度为0 CFU/25 g,非目标菌浓度为50~100 CFU/g)、低浓度污染样品63个(目标菌浓度为5~10 CFU/25 g,非目标菌浓度为50~100 CFU/g)和高浓度污染样品63个(目标菌浓度为50~100 CFU/25 g,非目标菌浓度为500~1 000 CFU/g)。