国内外“瘦肉精”使用情况与残留限量对比分析
作者: 栾稳稳 马艳梅 李新
摘 要:“瘦肉精”是一种β-肾上腺类神经兴奋剂,能提高饲料转化率,增加瘦肉率,显著改善胴体品质。虽然“瘦肉精”可通过尿液排出体外,但也会残留在动物的肝脏、肾脏、肌肉等组织器官中,进而危害人体健康。本文以此为背景论述了“瘦肉精”的危害,对国内外关于“瘦肉精”的可使用限量进行对比,并针对“瘦肉精”的管理问题提出改善建议。
关键词:瘦肉精;β-受体兴奋剂;残留限量(MRLS)
Comparative Analysis Using Status and the Residue Limits of “Clenbuterol” Domestic and Foreign
LUAN Wenwen, MA Yanmei, LI Xin
(SGS-CSTC Standards Technical Services Co., Ltd., Dalian Branch, Dalian 116000, China)
Abstract: “Clenbuterol” is a kind of β- Adrenal nerve stimulants can improve feed conversion rate, increase lean meat rate and significantly improve carcass quality. Although “clenbuterol” can be excreted from urine, it will remain in animal liver, kidney, muscle and other tissues and organs, endangering human health. Based on this background, this paper discusses the harm of clenbuterol, compares the limits of clenbuterol at home and abroad, and puts forward some suggestions for improving the management of clenbuterol.
Keywords: clenbuterol; β-agonist; Maximum Residue Limits (MRLS)
1 “瘦肉精”概述
继2011年3·15“瘦肉精”事件后,事隔10年2021年3·15“瘦肉精”事件再度上演。2021年3·15晚会曝光河北某县养殖户在活羊出栏前一个月喂食“瘦肉精”,以达到提高胴体的瘦肉率的目的。“瘦肉精”简称β-兴奋剂,主要成分包括盐酸克伦特罗、莱克多巴胺和沙丁胺醇等。“瘦肉精”不仅能有效提高饲料转化率,还能增加9%~16%的瘦肉率,降低8%~15%的骨骼肌脂肪,显著改善胴体品质。含有“瘦肉精”的猪牛羊屠宰后肉质颜色较深且鲜艳、纤维疏松,瘦肉多,卖相好[1]。此外,美国密歇根州立大学附属猪肉研究组的戴夫·汤普森(Dave Thompson)博士指出,“若是按照指导说明使用,盐酸莱克托巴胺(Ractopamine,RAC)可安全有效地提高猪的平均日增重和饲料转化率10~12个百分点,同时能提高猪肉的瘦肉率”。在商品猪出栏前不到1个月的时间内,RAC可使猪肉生产商每头育肥猪多挣9美元(而投资仅3美元),这是“瘦肉精”屡禁不止的根本原因[2]。
2 “瘦肉精”的危害
“瘦肉精”属于非蛋白质激素,耐热,动物食用后会在其组织中有蓄积性残留,内脏中的残留量最多。克伦特罗在动物体内主要发生氧化反应,药物通过肝脏代谢,大部分以尿液形式排出体外,在组织内的残留主要集中在肺、肝、肾脏、肌肉和脂肪组织中。肝组织具有残留消除缓慢、积累性强的特点,残留量随剂量增加和时间延长而增大[3]。
食用含有“瘦肉精”的畜产品及其制品后对人体危害很大,主要表现为急性中毒时出现心悸,面颈、四肢肌肉颤动,手指震颤,足部有沉重感甚至不能站立,头痛、头晕、恶心、呕吐、心慌或乏力,脸部潮红,皮肤出现过敏性红色丘疹等。对原有高血压、冠心病、糖尿病或甲状腺功能亢进者危害更大,甚至可能发生猝死[1]。
3 部分国家“瘦肉精”的使用情况以及兽药法规对“瘦肉精”的限量要求
关于“瘦肉精”,中华人民共和国农业农村部公告第250号,将β-兴奋剂(β-Agonists)类及其盐、酯列入食品动物中禁止使用的药品及其他化合物清单。
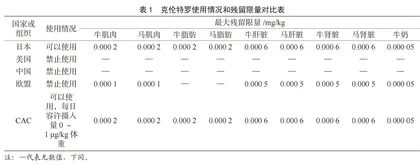
欧盟兽药残留法规Council Directive 96/22/EC[4]中规定,禁止在畜牧业中使用β-兴奋剂,而且在欧盟兽药残留法规Commission Regulation (EU) No 37/2010中规定了瘦肉精的残留限量,从表1中可看出对“瘦肉精”的限量较为严格。
美国FDA、EPA、USDA 3家机构相互协作来管理和监控国内的兽药市场。其中FDA下属的CVM(兽药中心)是依据FFDCA设立的专门负责兽药管理的消费者保护机构。在美国克伦特罗是禁止使用于动物的药物,而莱克多巴胺(RAC)在美国可以合法使用,日允许摄入量(Acceptable daily Intake,ADI)不超过1.25 μg/kg,在动物内脏(包括肝脏、肾脏)和眼睛等器官组织中,RAC含量水平更高并且持续更长时间内不能被代谢掉,但是北美人通常不食用动物内脏,而一些内脏在中国等国家却是被食用的[2,5-6]。从表2可看出美国对RAC限量相较于其他国家较为宽泛[7]。
日本厚生劳动省残留法规为《肯定列表制度》。除了肯定列表上规定的项目外,日本政府还发布年度进口食品的监控计划。从表1、表2可看出日本对动物组织各部位“瘦肉精”的规定较为全面和明确。
联合国粮食及农业组织及世界卫生组织颁布的国际食品标准(CAC),《食品中兽药残留的最大残留限量和风险管理建议》(CX/MRL2—2018)中指出克伦特罗可能出现滥用的情况,仅在用于国家批准的治疗用途时,如用于安胎或呼吸道疾病的辅助治疗时,才设定最大残留限量;莱克多巴胺的每日容许摄入量为0~1 μg/kg体重[8]。从表1、表2可看出其限量要求基本与日本一致。
4 “瘦肉精”问题改善建议
(1)各国对动物组织中“瘦肉精”的管控力度不同,欧盟最为严格,不但要求在动物养殖中禁止使用,而且对克伦特罗在动物组织中的残留量作出规定,残留限量严于其他国家。我国要求β-兴奋剂类(β-Agonists)不得在食源性动物中使用,但国内检测方法的检出限为0.000 5 mg/kg左右,由于受检测方法检出限的限制,部分动物组织的残留限量要求略宽松于欧盟、日本等国。因此,开发低检出限、灵敏度高的检测方法尤为重要。
(2)检测手段只能作为后端验证和监管的一种手段,“瘦肉精”的管控重点应放在前端畜禽养殖和饲料管理上。因此,养殖户应加强饲养管理、改变饲养观念,提高自身道德水平;同时企业在验收生肉时应向供应方索取相关检测结果并加强检测。
(3)政府应严格规范兽药的安全生产和使用,加强对兽药残留的监控,完善兽药残留监控体系,加强市场监督抽检力度,改进检验方法,并加大宣传力度,增加消费者的食品安全意识。
参考文献
[1]周霞,郑继军.非法添加“瘦肉精”监管难题分析[J].中国畜禽种业,2021,17(11):26-27.
[2]张振玲,特里纳·海因.关于第二代瘦肉精:盐酸莱克多巴胺[J].猪业科学,2021,38(10):20-22.
[3]田雨超,张宏雨,谷学佳,等.“瘦肉精”危害及检测方法[J].畜牧业环境,2021(13):17-20.
[4]Official Journal of the European Communities.COUNCIL DIRECTIVE 96/22/EC of 29 April 1996 concerning the prohibition on the use in stockfarming of certain substances having a hormonal or thyrostatic action and of beta-agonists, and repealing Directives 81 /602/EEC, 88/146/EEC and 88/299/EEC[EB/OL].(1996-04-29)[2022-04-10].https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:31996L0022&qid=1652689200749&from=EN.
[5]Office of the Federal Register. CFR Code of Federal Regulations Title 21—food and drugs Chapter I—food and drug administration department of health and human services Subchapter E—animal drugs, feeds, and related products part 556 tolerances for residues of new animal drugs in food—§ 530.41 Drugs prohibited for extralabel use in animals[EB/OL].(2022-06-16)[2022-06-17].https://www.ecfr.gov/current/title-21/chapter-I/subchapter-E/part-530/subpart-E/section-530.41.
[6]Office of the Federal Register. CFR Code of Federal Regulations Title 21—food and drugs Chapter I—food and drug administration department of health and human services Subchapter E—animal drugs, feeds, and related products part 556 tolerances for residues of new animal drugs in food § 556.570 Ractopamine[EB/OL].(2022-06-16)[2022-06-17].https://www.ecfr.gov/current/title-21/chapter-I/subchapter-E/part-556/subpart-B/section-556.570.
[7]Office of the Federal Register.CFR Code of Federal Regulations Title 21—food and drugs Chapter I—food and drug administration department of health and human services Subchapter E—animal drugs, feeds, and related products part 556 tolerances for residues of new animal drugs in food[EB/OL].(2022-06-16).[2022-06-17].https://www.ecfr.gov/current/title-21/chapter-I/subchapter-E/part-556?toc=1.
[8]Food and Agriculture Organization of the United Nations, World Health Organization.Maximum Residue Limits (MRLs) and Risk Management Recommendations (RMRs) for residues of veterinary drugs in foods [EB/OL].(2018-02-01)(2022-06-16).http://www.tbtsps.cn/pdfjs/showpdf.jsp?key=/printPdfServlet?jiamifoodlimitfilefid=cd12121a20b568c4.