液相色谱法测定植物源性食品中灭蝇胺
作者: 杨飞帆 赵舒景
摘 要:目的:建立液相色谱法测定植物源性食品中灭蝇胺的方法。方法:优化样品前处理方法,对植物源性食品中的灭蝇胺进行提取及净化。结果:灭蝇胺在浓度0~800 ng/mL均具有良好的相关性,其回收率、精密度等均可达到项目检测要求。结论:此方法适用于植物源性食品中灭蝇胺的测定。
关键词:植物源性食品;前处理;灭蝇胺;液相色谱
Determination of Cyromazine in Plant Derived Food by HPLC
YANG Feifan, ZHAO Shujing*
(Shanghai Chongming Institute for Food and Drug Control, Chongming Food Safety Testing Center, Shanghai 202150, China)
Abstract: Objective: To establish a method for the determination of cyromazine in plant-derived foods by liquid chromatography. Method: The sample pretreatment method was optimized to extract and purify cyromazine in plant-derived food. Result: Cyromazine had a good correlation at the concentration of 0~800 ng/mL, and its recovery rate and precision could meet the project detection requirements. Conclusion: This method is suitable for the determination of cyromazine in plant-derived foods.
Keywords: plant-derived foods; pre-processing; cyromazine; liquid chromatography
灭蝇胺又名环丙氨嗪,可以诱使双翅目幼虫和蛹在形态上发生畸变,成虫羽化不全或受抑制。其可用于控制动物厩舍内的苍蝇以及防治黄瓜、茄子、四季豆、叶菜类和花卉上的美洲斑潜蝇等农业害虫,是一种高效低毒杀虫剂[1]。
根据2021版国家食品安全监督抽检实施细则中的要求,对芹菜、豇豆、菜豆3类蔬菜有灭蝇胺项目的检测要求。随着检测技术的日益发展,植物源性食品中灭蝇胺的检测方法主要有高效液相色谱法[2-3]、液相色谱质谱联用法[4-5]和量子点荧光探针法[6]。根据《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2019)[7]的规定,蔬菜水果中的灭蝇胺均使用《蔬菜中灭蝇胺残留量的测定 高效液相色谱法》(NY/T 1725—2009)[8](以下简称标准方法)进行检测,该方法样品经提取浓缩,经SCX柱净化,以达到检测的效果,存在前处理复杂、有机溶剂使用量大等缺点。目前植物源性食品中农药残留的检测的前处理方法有固相萃取[9]、QuECHERS[10]和GPC-GCMS[11]等。本研究是在标准方法的基础上,通过不断改进前处理步骤、减少有机溶剂的使用量、优化检测条件等,达到灭蝇胺检测的目的。
1 材料与方法
1.1 材料与试剂
基质:豇豆(来源为市售产品,经检测后为灭蝇胺阴性样品)。
试剂:乙腈;乙酸铵;甲醇(色谱纯);灭蝇胺标准溶液(100 µg/mL),农业部环境保护科研监测所。
1.2 仪器与设备
高效液相色谱Agilent 1260,配有紫外检测器或二极管阵列检测器;电子天平梅特勒-托利多,精度0.01 g;高速匀浆机T18;高速离心机;涡旋仪;移液枪;旋转蒸发仪;氮吹仪;50 mL离心管;150 mL梨行瓶;各类一次性用品(滴管、贮液器、0.45 µm有机滤膜、2 mL注射管等)。
1.3 实验方法
1.3.1 溶液配制
灭蝇胺标准工作使用液的配制:吸取100 µL灭蝇胺标准溶液于10 mL容量瓶中,用乙腈定容至刻度,得浓度为1 µg/mL标准工作使用液。
1.3.2 线性分析
准确吸取灭蝇胺标准工作使用液,用乙腈配制成0 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL、400 ng/mL和800 ng/mL的标准系列溶液,注入HPLC,得到色谱图,以保留时间定性。以标准系列溶液中目标物的浓度为横坐标,色谱峰面积为纵坐标,绘制标准曲线。
1.3.3 样品前处理
(1)提取与浓缩。准确称取匀浆试样10 g于50 mL
离心管中,加入10 mL乙酸铵-乙腈溶液,高速匀浆2 min,取20 mL乙酸铵-乙腈溶液清洗均质刀头,洗液并入50 mL离心管中,用涡旋仪涡旋混匀1 min,用乙酸铵-乙腈溶液定容至50 mL。经低温高速离心机4 500 r/min离心5 min,得到固液分离的状态。
用移液枪准确吸取10 mL上清提取液至150 mL梨形瓶中,在旋转蒸发仪上浓缩至只含水溶液的状态(冷凝装置无液滴滴下),水浴温度为40 ℃。取下后加入2 mL盐酸溶液,待净化。
(2)净化。依次用5 mL甲醇、水淋洗活化强阳离子交换萃取柱(SCX),当液面到达柱吸附层表面时,立即将带净化的溶液转移至SCX柱中,再用
5 mL盐酸溶液分两次清洗150 mL梨形瓶中残留物,并全部转至SCX柱中。然后依次用5 mL水、甲醇淋洗SCX柱,弃去所有流出液并将SCX柱抽干。将SCX柱置于另一洁净的150 mL梨形瓶上,SCX柱上加贮液器,加入15 mL氨水-甲醇溶液进行洗脱。收集洗脱液,并在旋转蒸发仪上,水浴温度40 ℃,浓缩至近干,氮吹仪吹干,最后用2 mL乙腈-水溶液复溶,过0.45 µm有机微孔滤膜,上液相色谱检测。
1.3.4 液相色谱检测条件
色谱柱:NH2柱(4.6 mm×250 mm,5 µm);流动相:乙腈-水溶液(98+2);流速:1.0 mL/min;进样体积:30 µL;检测波长:215 nm;柱温:35 ℃。
2 结果与分析
2.1 目标物提取方式的选择
农药残留目标物的提取前处理有很多种方式,可选择直接涡旋混匀、超声提取、振荡提取以及均质提取等方式。本法选择均质提取的方式,通过使用阳性样品对比实验数据显示,均质提取法样品提取更完全。
2.2 样品定容方式的选择
标准方法中是称取20 g样品,使用100 mL的比色管定容,并采用布氏漏斗过滤的方式获得提取液。方法存在样品量大、提取溶剂用量大和固液分离方法烦琐等缺点。本法采用的是称取10 g样品,用50 mL离心管定容,采用离心机进行固液分离,减少了样品和提取溶剂的用量,简化了分离方法,提高了分离效率。
2.3 色谱柱的选择
色谱检测过程中,一般有两类色谱柱可进行选择,即正相色谱柱和反相色谱柱。流动相极性大于色谱柱的为反相色谱,最常见的为C18柱,常用于分离极性化合物。反之为正相色谱,常用于分离弱极性的化合物,灭蝇胺为弱极性化合物,所以选择正相色谱柱NH2柱进行检测。
2.4 流动相的选择
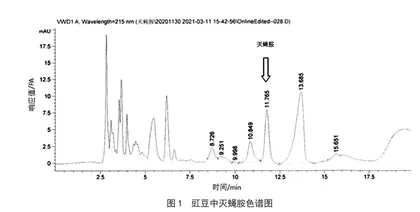
反相色谱柱的使用与正相色谱柱相反,水相比例不宜太大,否则会影响分离效果。标准方法中推荐使用乙腈-水(97+3),实际实验过程中发现,当以豇豆为基质时,存在杂峰与目标峰的分离度达不到检测要求,影响检测效果。通过增加有机相比例,调整乙腈-水(98+2),结果显示分离度完全能达到实验要求,分离效果优于原比例。同时,乙腈-水(98+2)溶液需要提前配制,若将水溶液和乙腈溶液按照2∶98的比例在线混合,会出现因水相占比太低,产生混合不均匀的情况,从而导致目标物的出峰时间存在一定的漂移,影响结果的判定。豇豆中灭蝇胺色谱图见图1。
2.5 进样体积的选择
实验发现,当进样量为10 µL时,检出限浓度的响应极小,再加上基质的干扰,很难达到准确检测的目的。通过增加进样量至30 µL,可以使信噪比完全达到实验要求。
2.6 线性相关性
当灭蝇胺浓度为0~800 ng/mL,具有良好的相关性,线性相关系数r>0.999 9,线性回归方程为y=345.737 13x-0.291 771。
2.7 回收率和精密度
通过豇豆样品加标回收来考察方法的准确度,通过同水平加标的6个平行样品间的相对标准偏差(RSD)来考察方法的精密度。称取18份豇豆样品进行3水平(检出限0.02 mg/kg、方法定量限0.06 mg/kg、最高限量0.5 mg/kg)加标测定。通过标准系列方程读取测定浓度结果,计算样品本底值、加标回收率以及相对标准偏差。回收率和精密度结果见表1。
由表1可知,灭蝇胺加标回收率为75.0%~
112.0%,相对标准偏差均小于20%,其回收率和精密度均符合检测要求,说明本方法具有良好的准确度和稳定性。
3 结论
本研究在标准方法的基础上,对豇豆中灭蝇胺残留检测的前处理方法进行优化,使操作更加简单、高效,减少样品和提取溶剂的用量。灭蝇胺在浓度0~800 ng/mL,均具有良好的相关性,且其回收率、精密度等均可达到项目检测要求,对其他植物源性食品中灭蝇胺的检测也有一定的参考
价值。
参考文献
[1]刘瑛,余晟,于峰,等.灭蝇胺的毒性研究[J].农药,2000(9):25-33.
[2]董娇,曹宁阳,耿鑫.全自动固相萃取-高效液相色谱测定蔬菜中灭蝇胺残留[J].现代食品,2018(4):94-98.
[3]周杨,陈悦.改良高效液相色谱法快速测定豇豆中灭蝇胺[J].中国食品,2020(19):123-124.
[4]张从文,李红梅.蔬菜中灭蝇胺残留量的液质联用分析方法[J].安徽农学通报,2018,24(22):91.
[5]吴淑秀,崔淑华,公茂金,等.水果和蔬菜中灭蝇胺的液相色谱-串联质谱测定法[J].环境与健康杂志,2012,29(10):936-938.
[6]谭华东,赵淑巧,武春媛.CdSe/CdS量子点荧光探针测定蔬菜中灭蝇胺的残留量[J].分析测试学报,2019,38(10):1207-1212.
[7]国家卫生健康委员会,农业农村部,国家市场监督管理总局.食品安全国家标准 食品中农药最大残留限量:GB 2763—2021[S].北京:中国标准出版社,2021.
[8]中华人民共和国农业部.蔬菜中灭蝇胺残留量的测定 高效液相色谱法:NY/T 1725—2009[S].北京:中国标准出版社,2009.
[9]杨秦,张耀海,周杰,等.磁性分散固相萃取-QuEChERS结合气相色谱-串联质谱法检测不同柑橘基质中多种农药残留[J].农药学学报,2021,23(2):395-404.
[10]王军.新型QuEChERS净化材料和食品中农药残留检测方法研究[D].西安:陕西师范大学,2020.
[11]仇婷婷,陆萍,蒋丽君,等.GPC-GCMS测定蔬菜中特丁硫磷残留的不确定度评定[J].农技服务,2020,37(10):30-32.