动物源性面制品中氨基脲来源分析
作者: 郭思言 王俊苏 郗存显 唐柏彬 郑小玲 莫敏 郑文 关天横 李贤良
摘 要:为研究动物源性面制品(炸鸡腿、面包虾)中氨基脲(Semicarbazlde,SEM)的来源,用不含偶氮甲酰胺(Azodicarbonamide,ADC)的面粉及含有不同浓度水平的ADC面粉对肉制品进行处理,采用液相色谱串联质谱法测定处理后肉制品中ADC的主要降解产物联二脲(Biurea,BIU)和SEM的生成量。结果表明,部分用不含ADC面粉制作的面包虾中含有SEM,不含BIU,推测SEM为内源性物质,添加ADC的面粉制作的肉制品中均能检出BIU和SEM,含量远高于不含ADC的面粉,且检出含量与ADC添加量呈正相关。因此,动物源性面制品中SEM的来源可用BIU含量作为判定依据。
关键词:动物源性面制品;偶氮甲酰胺;联二脲;氨基脲;来源分析
Analysis of Semicarbazlde Source in Animal Derived Flour Products
GUO Siyan, WANG Junsu*, XI Cunxian, TANG Bobin, ZHENG Xiaoling, MO Min, ZHENG Wen, GUAN Tianheng, LI Xianliang
(Chongqing Customs Technology Center, Chongqing 400020, China)
Abstract: In order to study the source of semicarbazolde (SEM) in animal derived flour products (fried chicken leg, bread shrimp), the meat products were treated with flour without azodicarbonamide (ADC) and flour with different concentrations of ADC. The production of biurea (BIU), the main degradation product of ADC, and SEM in the processed meat products were determined by liquid chromatography tandem mass spectrometry. The results showed that some bread shrimp made with flour without ADC contained SEM, but did not contain BIU. It was speculated that SEM was an endogenous substance. BIU and SEM could be detected in meat products made with flour with ADC, and the content was much higher than that of flour without ADC, and the detected content was positively correlated with the amount of ADC added. Therefore, the source of SEM in animal derived flour products can be determined by the content of BIU.
Keywords: animal derived flour products; azoformamide; biurea; semicarbazide; source analysis
氨基脲(Semicarbazlde,SEM)又称氨基甲酰肼,是一种联胺类小分子化合物,通常被认为是抗生素呋喃西林药物的特征性代谢物[1]。SEM致癌性强,国外对呋喃西林药物实行禁用后,禽肉中SEM超标的样品数量却屡增不减,同时欧盟在植物源性的罐装食品中也发现SEM,SEM的来源引起了广泛关注[2-3]。SEM在动物源性面制品中的来源之一是呋喃西林药物代谢物,作为稳定的代谢产物,化学性质较原药稳定,因此往往被作为呋喃西林药物的检出依据;另一来源是面粉添加剂偶氮甲酰胺(Azodicarbonamide,ADC)的降解代谢物,ADC在高温高湿环境下,会降解生成SEM,对于甲壳类水产面制品类如炸虾,SEM还可能是内源性物质[4-6]。于慧娟等[7]研究发现SEM作为内源性物质普遍存在于虾、蟹等甲壳类水产品中,经过文献查阅大部分国内对虾内源性SEM含量约在1 μg·kg-1[8]。由于ADC在降解过程中还有另一主要降解产物联二脲(Biurea,BIU),且BIU不会由氨基脲转化而来,因此SEM是否由ADC降解产生,可通过测定ADC的降解产物BIU进行辨别。
本文通过制作添加ADC的炸鸡和炸虾,建立了液相色谱质谱联用法测定动物源性面制品中BIU的方法[9-10]。同时参考标准方法GB/T 21311—2007中的前处理方式,在步骤中增加蛋白沉淀环节,建立了测定SEM的方法。探究了面粉及动物源性面制品中ADC、BIU和SEM三者的含量关系,为食品中SEM的污染来源提供了判断依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
面粉、鸡腿肉、虾肉,均购自当地超市;BIU(纯度≥99.5%,美国Chem Service);ADC(纯度≥99%,美国Sigma公司);13C2,15N2-BIU(纯度≥99.5%,加拿大Toronto Research Chemicals公司);SEM(纯度≥99%)、13C,15N2-SEM(纯度≥99%),德国Dr. Ehrenstorfer公司;水为超纯水,Millipore超纯水仪制备;邻硝基苯甲醛(纯度≥98%,美国Sigma公司);乙酸锌(上海强顺化工试剂有限公司);盐酸、氢氧化钠、磷酸二氢钾和亚铁氰化钾(分析纯,重庆川东化学试剂厂);高锰酸钾(重庆川东化工有限公司);乙腈、正己烷、二甲亚砜和乙酸乙酯(色谱纯,美国TEDIA公司);甲酸(纯度>99%,美国ROE公司);冰醋酸(色谱纯,美国FLUKA公司);对甲苯亚磺酸钠(纯度>95%,美国Sigma公司);乙酸铵(纯度>99%,美国Sigma公司)。
1.1.2 仪器
API 4000高效液相色谱串联质谱仪(AB sciex,美国);强力振荡器(北京安捷来科学仪器设备有限公司);Sartorius BS224S型天平(赛多利斯科学仪器有限公司);XH-B型旋涡混合器(江苏康健医疗用品有限公司);Milli-Q超纯水系统(Millipore,美国);3-30K型离心机(Sigma,德国)。
1.2 实验方法
1.2.1 面糊的制备
准确称取30 g面粉,分别添加浓度水平为0 mg·kg-1、10 mg·kg-1、20 mg·kg-1和45 mg·kg-1的ADC标液,加入40 mL水搅拌混匀调成面糊。
1.2.2 炸鸡腿的制备
新鲜鸡腿洗净,用刀在每个鸡腿上都划几刀,在鸡腿上均匀挂一层1.2.1中制作的面糊;炸锅里的油温加热约达150 ℃(约五六成热),将鸡腿轻轻放入油锅中,并用筷子不停地翻面,直到将鸡腿炸成金黄色为止,捞出后沥油。取鸡腿的面粉层、鸡肉内层、鸡肉外层分别制样。
1.2.3 炸虾球的制备
取鲜虾去头、尾和虾壳,于粉碎机内粉碎,称取10 g虾肉揉搓成球状,为了使虾肉成型,可以沾上薄薄的一层淀粉,将虾球放入1.2.1制作的面糊中,裹上一层面糊;炸锅里的油温加热约达150 ℃,将裹上面粉浆的虾球轻轻放入油锅中,并用筷子不停翻面,直到将虾球炸至焦黄色熟透为止,捞出后沥油。取虾球的面粉外壳、虾球内层、虾球外层分别制样。
1.2.4 标准曲线的配制
准确称取适量BIU和13C2,15N2-BIU标准品,用水溶解并配制成浓度为20 mg·L-1的BIU标准储备液和浓度为10 mg·L-1的13C2,15N2-BIU内标工作液。室温储存,有效期1个月。根据需要取适量的标准储备液用水稀释成1 μg·L-1、5 μg·L-1、10 μg·L-1、100 μg·L-1、1 000 μg·L-1和20 000 μg·L-1的系列标准工作液,临用现配。
准确称取适量SEM和13C,15N2-SEM标准品,用甲醇溶解并配制成浓度为100 mg·L-1的SEM标准储备液和13C,15N2-SEM内标工作液,-18 ℃保存,有效期3个月。根据需要取适量的标准储备液用甲醇稀释成0.5 μg·L-1、1.0 μg·L-1、5.0 μg·L-1、10.0 μg·L-1、50.0 μg·L-1和100.0 μg·L-1的系列标准工作溶液,临用现配。
1.2.5 BIU的测定
(1)样品前处理。准确称取2.0 g(精确至0.001 g)样品于50 mL离心管中,分别加入浓度为10 mg·L-1 13C2,15N2-BIU内标工作液0.2 mL和10 mL水,涡旋混匀,采用5 mL正己烷脱脂后,于振荡器上振荡提取15 min,8 000 r·min-1离心5 min,吸取上层清液于25 mL比色管中,重复提取1次,合并提取液,分别加入2 mL 1.00 mol·L-1乙酸锌溶液与0.25 mol·L-1亚铁氰化钾溶液,用水稀释至刻度,提取液转移至50 mL离心管,加入5 mL正己烷,8 000 r·min-1离心3 min,准确吸取5 mL下层待测液于另一离心管中,加入200 μL 0.14 mol·L-1高锰酸钾溶液,振荡反应30 min,加入50 μL二甲基亚砜,振荡3 min后,加入2.5 mmol·L-1对甲苯亚磺酸钠溶液5 mL,振荡衍生反应10 min,离心,过0.22 μm有机滤膜后供液相色谱质谱分析。
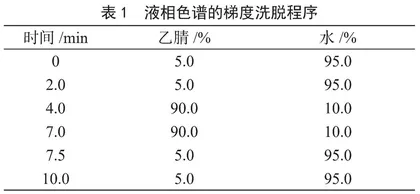
(2)色谱测定条件。色谱柱:Shimpak XR-ODSⅡ(150 mm×2.0 mm,2.2 μm);流动相A为乙腈,流动相B为2 mmol·L-1乙酸铵溶液(含0.2%甲酸);流速:0.3 mL·min-1;柱温:40 ℃;进样量:10 μL;梯度洗脱程序见表1。
(3)质谱条件。离子源:电喷雾离子源(ESI);离子化模式:正离子模式;扫描方式:多反应监测(MRM)模式;离子源温度(TEM):650 ℃;毛细管电压(IS):5 500 V;气帘气压力(CUR):35 psi;雾化气压力(GS1):80 psi;辅助气压力(GS2):50 psi;监测离子对、驻留时间、去簇电压和碰撞电压等参数见表2。
1.2.6 SEM的测定
(1)样品前处理。称取1 g样品(精确至0.001 g)于50 mL离心管中,分别加入浓度为20 μg·L-1的13C,15N2-SEM内标溶液100 μL,用10 mL 0.1 mol·L-1盐酸溶液提取,加入200 μL 0.1 mol·L-1邻硝基苯甲醛溶液(二甲亚砜配制)衍生,涡旋混匀,置于37 ℃恒温箱中振荡反应16 h。取出样品,待冷却至室温后加入1.0 mol·L-1磷酸二氢钾溶液5 mL,用1.0 mol·L-1氢氧化钠溶液调节pH值至7.0~7.5,依次加入2 mL 106 g·L-1亚铁氰化钾溶液和220 g·L-1乙酸锌溶液沉淀剂,加入15 mL乙酸乙酯提取,离心,收集乙酸乙酯层于旋蒸瓶,重复提取1次,于40 ℃下水浴旋转蒸发至近干,加入1 mL乙腈-水(2∶8,V/V)溶解残渣,用2 mL乙腈饱和的正己烷脱脂,样液过0.22 μm滤膜后供液相色谱质谱分析。
(2)色谱测定条件。高效液相色谱-质谱/质谱仪:四极杆串联质谱;离子源类型:ESI;色谱柱:Shimadzu VP-ODS C18(150 mm×2.0 mm,5 μm);流动相A为乙腈,流动相B为水;流速:0.3 mL·min-1;柱温:40 ℃;进样量:20 μL;梯度洗脱程序见表3。
(3)质谱条件。离子源:电喷雾离子源(ESI);离子化模式:正离子模式;扫描方式:多反应监测(MRM)模式;毛细管电压:5 500 V;离子源温度(TEM):550 ℃;气帘气(CUR):45 psi;雾化气(GS1):20 psi;辅助气(GS2):60 psi;碰撞气(CAD):10 psi;监测离子对、驻留时间、去簇电压和碰撞气能量等参数见表4。