铜和乙烯处理对花生白藜芦醇合成酶基因及相关基因的影响
作者: 包学锋 蒋春姬 董旋 金兰淑 林国林
摘要 为了确定铜和乙烯处理下花生白藜芦醇合成酶基因以及转录因子,采用高效液相色谱法测定白藜芦醇含量,对应处理组进行转录组学测定和生物信息学分析。结果表明,0.1 mmol/L铜处理可促进花生产生白藜芦醇,5 mmol/L乙烯处理下花生白藜芦醇含量十分微量,铜和乙烯组合处理下花生白藜芦醇含量较少,比铜处理组下的含量少92.2%,比乙烯处理下的含量多8.4倍。铜和乙烯处理对白藜芦醇合成酶基因STS1、STS2、STS3的启动起到正调控作用,转录因子MYB4、MYB73与白藜芦醇合成酶基因有良好的结合位点。
关键词 花生;白藜芦醇;铜和乙烯处理;转录因子;白藜芦醇合成酶基因
中图分类号 S565.2 文献标识码 A
文章编号 0517-6611(2025)06-0001-06
doi:10.3969/j.issn.0517-6611.2025.06.001
Effects of Copper and Ethylene Treatment on Peanut Resveratrol Synthase Genes and Related Genes
BAO Xue-feng JIANG Chun-ji DONG Xuan1 et al
(1.Shenyang Agricultural University,Shenyang,Liaoning 110000; 2.Xichang College,Xichang,Sichuan 615000)
Abstract In order to determine the resveratrol synthase gene and transcription factors of peanut under copper and ethylene treatment,the resveratrol content was determined by high-performance liquid chromatography(HPLC),and transcriptomics and bioinformatics analysis were performed on the corresponding treatment groups.The results showed that 0.1 mmol/L copper treatment could promote the production of resveratrol in peanuts.Under 5 mmol/L ethylene treatment,the resveratrol content in peanuts was very ting.Under the combination of copper and ethylene treatment,the resveratrol content in peanuts was lower,92.2% lower than that under copper treatment and 8.4 times higher than that under ethylene treatment.Copper and ethylene treatment have a positive regulatory effect on the activation of resveratrol synthase genes STS1,STS2 and STS3,and transcription factors MYB4 and MYB73 have good binding sites with resveratrol synthase genes.
Key words Peanut;Resveratrol;Copper and ethylene treatment;Transcription factor;Resveratrol synthase gene
白藜芦醇是一种酚类化合物,从植物中第一次被提取至今已有80年之久,因其具有良好的抗氧化、抗炎、抗肿瘤作用被学界广泛关注[1-2]。植物产生一定量的白藜芦醇可以有效缓解氧化产物过量积累的问题[3]。有效浓度的金属离子刺激能促使植物产生一定浓度的白藜芦醇[4-6];激素类物质的外源诱导也可促使植物合成并积累白藜芦醇[7-8]。植物体内白藜芦醇的合成是通过苯丙氨酸代谢途径来完成。白藜芦醇的生成需要4-香豆酰辅酶A、丙二酰辅酶A 2种底物,生成4-香豆酰辅酶A的关键酶是苯丙氨酸解氨酶(PAL)、肉桂酸4-羟基酶(C4H)、香豆酸辅酶A连接酶(4CL),丙二酰辅酶A由乙酰辅酶A和生物素羧化酶两者合成,除此之外2种反应底物还得需要白藜芦醇合成酶的参与才能有效合成白藜芦醇[3]。
白藜芦醇合成酶的合成需要白藜芦醇合成酶基因(STS)的启动,研究表明葡萄中STS的启动被转录因子MYB14、MYB15所调控[9]。铜和乙烯不同处理促使花生合成白藜芦醇[10]。在花生合成白藜芦醇的过程中转录因子MYB14、MYB15的调控作用鲜有报道,为了探究这一问题,该试验试图通过对转录组数据进行聚类分析,确定铜和乙烯处理促使花生幼芽合成白藜芦醇的关键基因及其转录因子,以期为铜、乙烯处理促使花生幼芽合成白藜芦醇的转录调控分子机制研究提供科学依据。
1 材料与方法
1.1 种子萌发与培养 选取源自中国山东省的优质花生品种海花1号,精心挑选出100粒外形饱满、尺寸统一的花生种子作为试验对象。将这些经过筛选的种子用蒸馏水彻底清洗后,放入35 ℃的恒温水浴设备中,浸泡于蒸馏水中持续8 h[11],将浸泡完成的种子平整地摆放于规格为35 cm×27 cm的专用培养托盘内,其上覆盖经过消毒处理的毛巾,并适量喷洒蒸馏水,以维持种子的湿润度。在29 ℃且无光照的环境下对种子进行为期3 d的培育,使其顺利发芽,芽长达到2~3 cm时,继续保持上述培养条件,延长培育时间至7 d。选取具有发达纤维状根的花生芽以及长度在4~5 cm、质量在 4~5 g的花生芽作为后续试验的研究样本[10]。
1.2 处理试验 该研究所使用的化学试剂为CuSO4和乙烯利。针对铜与乙烯的协同处理试验,借助量筒准确量取225 mL 的双倍浓度处理溶液。该试验共设有4种不同的处理方式,具体为对照组(CK),CuSO4和乙烯利的浓度均为0 mmol/L;铜处理组(Cu),仅添加了0.1 mmol/L的CuSO4;乙烯处理组(ET),仅添加了5 mmol/L乙烯利;铜与乙烯的复合处理组(Cu_ET),同时添加了0.1 mmol/L的CuSO4和5 mmol/L的乙烯利。每种处理均安排了3个生物学重复,每个重复包含6株花生幼苗。在处理过程中,将花生幼苗的根部置于500 mL的透明塑料容器中,用450 mL的相应处理溶液进行浸泡,浸泡时间为48 h。处理期间,实验室内保持25 ℃,并且全程处于黑暗无光照的状态。
1.3 样品提取 将液氮处理过的花生根放入研磨机中,在1 700 r/min下研磨15 s,将所得的研磨浆转移至离心管中称重,加入10 mL的80%甲醇萃取液。在280 r/min、40 ℃条件下,恒温摇床中振荡60 min,用超声仪在50 ℃超声180 min,再用离心机在4 000 r/min条件下离心15 min。离心样品缓慢过滤到50 mL烧杯中,使用有机过滤器(孔径0.22 μm)将滤液进一步过滤到2 mL棕色小瓶中,滤液在-40 ℃下保存,待用高效液相色谱(HPLC)测定。
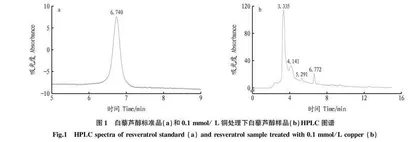
1.4 高效液相色谱分析 该试验借助安捷伦1100系列的高效液相色谱设备来检测白藜芦醇含量。该设备装配了型号为DE11115754的四元泵、型号为DE11113430的DAD检测器(采用光电二极管阵列检测技术,检测波长为306 nm)、Spursil C18色谱柱(250 mm×4.6 mm,5 μm)。采用等度洗脱法,在15 min内实现完全洗脱,洗脱溶剂由去离子水、高纯度甲醇(纯度≥99.9%,Sigma-Aldrich公司生产)、高纯度乙腈(纯度≥99.9%,上海安培尔科学仪器有限公司)组成,三者的体积配比为去离子水50%、甲醇20%、乙腈30%。在每个检测时间点,进样体积为20 μL,色谱柱的温度维持在30 ℃,流动相的流速控制在0.8 mL/min。通过对标准样品的保留时间和吸光度进行分析,实现对白藜芦醇的定性和定量检测,标准样品的保留时间在6.76~6.78 min,吸光度在306 nm下进行测定(图1)。白藜芦醇的标准曲线是基于购自中国上海远野生物科技有限公司的白藜芦醇标准品制作而成。使用电子天平精确称量5 mg样品,以甲醇作为溶剂,将其溶解并定容至50 mL容量瓶中,制备成100 μg/mL的母液,按照试验要求,将母液稀释成0.1、0.5、1.0、5.0、10.0、50.0 μg/mL标准品溶液,随后采用高效液相色谱法对这些不同浓度的标准品溶液进行检测,依据白藜芦醇标准品浓度与相应峰面积积分值之间的对应关系,绘制出标准曲线[12]。
1.5 处理后花生幼芽白藜芦醇含量的统计方法 对经过48 h处理的新鲜花生根样本,利用高效液相色谱法进行分析检测,并借助预先构建的标准曲线来精准计算各样本中白藜芦醇的含量。对于获取的所有试验数据,统一采用Microsoft Excel 2016软件进行初步的数据整理与分析。进一步的统计分析则借助SPSS 22.0软件,采用单因素方差分析法、Duncan多重比较法来评估不同处理组之间的差异显著性。利用Origin 2019软件将分析结果以直观的直方图形式呈现出来。
1.6 转录组样品提取 在完成48 h的处理程序之后,将花生幼苗取出,首先使用蒸馏水对其根部进行彻底冲洗,清除根部表面残留的处理溶液。随后,利用定性滤纸轻柔地擦拭根部,以吸干残留的蒸馏水。接着,用剪刀小心地剪下幼苗的根部,并将其迅速转移至50 mL离心管内。最后,迅速向离心管中加入液氮,使根部组织迅速冷冻,以便后续的试验操作和保存。
1.7 RNA提取、cDNA准备和RNA-seq 依据试剂盒生产商提供的指南,采用植物总RNA提取试剂盒从100~200 mg的冷冻样本中单独提取总RNA。通过1%(W/V)的琼脂糖凝胶电泳以及在260、280 nm下的分光光度计测量,评估总RNA的完整性和品质。挑选出260 nm/280 nm吸光度比为1.8~2.0的RNA样本,用于后续的试验分析。将每个样本中10 μg(500 ng/μL)的高质量总RNA送往上海派森诺生物技术有限公司进行深度测序和数据集构建。具体操作:利用低聚磁珠从大约5 μg的总RNA中分离出mRNA,将分离得到的mRNA分解为约200个核苷酸长度的短片段,并借助随机六聚物引物将其转录为第一链cDNA。接着,运用RNase H和DNA聚合酶I合成第二链cDNA,再利用QIAquick PCR纯化试剂盒进行纯化,并在3′末端添加碱基a进行末端修饰,将测序接头连接至双链cDNA的两端(长度为200±25个碱基对),以进行PCR扩增。最终,双链cDNA的测序工作在HiSeqTM 2000测序仪上,采用双端测序技术一次性完成。利用Illumina GA Pipeline(1.6版)对原始图像数据进行序列处理和碱基质量值计算,从而获得125个碱基对的双端读取序列。
2 结果与分析
2.1 铜、乙烯处理下花生幼芽根重的比较 从图2可以看出,对海花1号进行铜和乙烯不同处理48 h后,CK处理组的6个幼苗根重平均值为4.93 g,与交互处理组(Cu_ET)差异不显著(P>0.05),与铜处理组(Cu)和乙烯处理组(ET)差异显著(P<0.05)。铜处理、乙烯处理以及铜和乙烯的交互处理均会使花生幼芽的根重降低,乙烯处理(ET)下根均值为3.26 g,对根重影响最大;铜处理(Cu)影响次之,交互处理(Cu_ET)影响最小。
2.2 铜、乙烯处理下花生幼芽根中白藜芦醇含量的比较 从图3可以看出,铜处理(Cu)下花生幼芽根部白藜芦醇含量最多,为668.4 ng/g,与其他3组差异显著(P<0.05)。此外,铜处理(Cu)分别高于交互处理(Cu_ET)、乙烯处理(ET)白藜芦醇含量的11.8和120.1倍;而CK处理下,花生幼芽根部白藜芦醇含量并未检出。