铜绿假单胞菌外膜蛋白I载体疫苗构建及免疫效果研究
作者: 张艳琪 胡基华 曲晓军铜绿假单胞菌(Pseudomonasaeruginosa,Pa)可引起人类和畜禽感染,给人体健康及养殖业造成较大危害[1-2]。 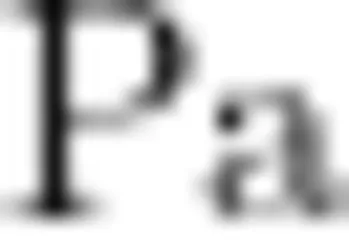 通过升高泵出系统活跃度、产生抗菌活性酶等多种机制增强耐药性,导致抗生素治疗效果不明显[3-4]。疫苗可高效、特异防治致病菌感染,且不会造成肠道菌群失调[5]。目前研发的Pa鞭毛疫苗、脂多糖疫苗、灭活疫苗和减毒疫苗等在保护范围和副作用方面有一定缺陷[]。
通过升高泵出系统活跃度、产生抗菌活性酶等多种机制增强耐药性,导致抗生素治疗效果不明显[3-4]。疫苗可高效、特异防治致病菌感染,且不会造成肠道菌群失调[5]。目前研发的Pa鞭毛疫苗、脂多糖疫苗、灭活疫苗和减毒疫苗等在保护范围和副作用方面有一定缺陷[]。 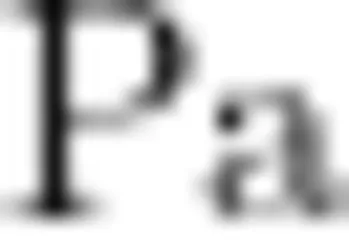 外膜蛋白I(Outer mem-braneprotein 1,0pr )可引起多种类型免疫应答,可交叉免疫保护,是良好的疫苗研制靶向蛋白[7]。重组载体疫苗是研究的热点和趋势,常用载体包括痘病毒、沙门菌、卡介苗等[8]目前已研制出OprI蛋白重组沙门氏菌疫苗等。但减毒伤寒沙门氏菌载体,对老年人、儿童和免疫缺陷者应用存在着一定风险[1o]。乳酸乳球菌(Lactococcus lactis)是食品级微生物,对人和动物无致病性[11]。L.lactis易于构建基因表达载体,具有转化率高,不持续刺激免疫系统,可作为免疫佐剂等优点,目前已成功表达多种蛋白、细胞因子[12-13]。笔者旨在构建表达
外膜蛋白I(Outer mem-braneprotein 1,0pr )可引起多种类型免疫应答,可交叉免疫保护,是良好的疫苗研制靶向蛋白[7]。重组载体疫苗是研究的热点和趋势,常用载体包括痘病毒、沙门菌、卡介苗等[8]目前已研制出OprI蛋白重组沙门氏菌疫苗等。但减毒伤寒沙门氏菌载体,对老年人、儿童和免疫缺陷者应用存在着一定风险[1o]。乳酸乳球菌(Lactococcus lactis)是食品级微生物,对人和动物无致病性[11]。L.lactis易于构建基因表达载体,具有转化率高,不持续刺激免疫系统,可作为免疫佐剂等优点,目前已成功表达多种蛋白、细胞因子[12-13]。笔者旨在构建表达 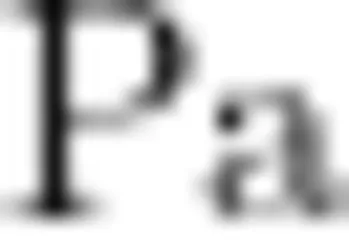 外膜蛋白I的重组L.lactis载体疫苗,评价构建的载体疫苗免疫效果,以期为研发可防治Pa感染的疫苗奠定基础。
外膜蛋白I的重组L.lactis载体疫苗,评价构建的载体疫苗免疫效果,以期为研发可防治Pa感染的疫苗奠定基础。
1材料与方法
1.1试剂、实验动物和菌株溶菌酶,购自美国Ameresco公司;限制性内切酶、高效连接酶、KODPlus购自东洋纺(上海)生物科技有限公司;DNA基因组、质粒提取试剂盒、PCR产物纯化、胶回收试剂盒购自OMEGABio-Tek公司;HRP标记羊抗鼠IgG和IgE购自SouthernBiotech公司; 2× ESTaqMastermix购自北京康为世纪生物科技有限公司;其他试剂市售所得,均为AR级。ICR品系清洁级小白鼠,雌性, 14~16g ,中国医学细菌保藏管理中心铜绿假单胞菌专业实验室自繁自养。L.lactisMG1363菌株,购自宝生物工程(大连)有限公司;大肠杆菌 菌株、pMG36c质粒 抗原,为中国医学细菌保藏管理中心铜绿假单胞菌专业实验室保存。试验于2022年9月—2024年4月在中国医学细菌保藏管理中心铜绿假单胞菌专业实验室进行。
1.2主要仪器T100型梯度PCR仪、550型酶标仪、1652100型电转化仪,美国Bio-Rad公司生产;DYCZ-24FN型电泳仪、WD-9413BX型凝胶成像分析系统,北京市六一仪器厂生产;TGL-16GB型高速台式离心机,上海安亭科学仪器厂生产;VCX1500型超声波破碎仪,美国Sonics公司生产。
1.3 重组质粒构建
1.3.1DHa菌株氯霉素( Cm) 敏感试验。浓度梯度:液体 LB 培养基为 2.0,4.0,6.0,8.0,10.0up/mL ;固体LB 培养基 为6.0,8.0,10.0,12.0,14.0up/mL将DHa菌株以 2% 接 种量接入LB液体和固体培养基,每组设置3个平行, 恒温静置培养 16h。
1.3.2DH5a感受态细胞制备及pMG36c质粒电转化。DH5a菌株接种 LB 液体培养基, 振荡培养至 OD600=0.5;培养物冰浴20min,7100g,4℃离心 10min ,分别用预冷灭菌 和 10% 甘油洗涤菌体,离心;预冷甘油悬浮菌体, 保存;感受态细胞冰上融化,加入0.5upuLMG36cDNA,混匀;混合物吸入预冷电转化杯底部,电激,程序为2.5kV、200;向电转化杯中加入920uL LB 培养基,移至离心管中, 37℃振荡培养 0.5~1.0h ;涂布含 Cm 的LB固体培养基, 培养转化子。
1.3.3 pMG36c 质粒提取及酶切验证。转化子在含 Cm 的LB液体培养基中活化,镜检,提取质粒;将质粒单酶切和双酶切验证,反应体系见表1。
本文为全文原貌 未安装PDF浏览器用户请先下载安装
原版页码:ankx20250715.pd原版全文
1.3.4MG1363菌株 Cm 敏感性试验。浓度梯度:GM17液体和固体培养基均为 2.0,4.0,6.0,8.0,10.0g/mL。 2% 接种量接入培养基中,每组设置3个平行, 30% 静置培养 36~48h 。1.3.5MG1363菌株感受态细胞制备及电转方法。参考王洋等[14]的方法,并进行优化,即细胞生长状态( 、0.5,0.7,0.9,1.2) ,复壮时间 (1、3、5、7、9h) ,质粒添加量( 60,80,100,120,140ng) 和转化电压(1.0、1.5、2.0、2.5、3.0kV )为单因素。计算电转化效率:
电转化效率(CFU\DNA})=菌落总数 (CFU DNA1.3.6重组质粒 pMG36c-OprI 构建。试剂盒提取 Pa27853 菌株基因组DNA;根据GenBank中 的OprI基因序列和pMG36c载体特点设计引物(表2),其中P32-F根据pMG36c载体上的P32启动子序列进行设计。
以 Pa DNA为模板,PCR扩增 基因,反应体系见表3。扩增条件 共30个循环,最后 延伸 5min 。取5~LPCR产物用于 琼脂糖凝胶电泳。
重组质粒构建:无缝连接试剂盒连接,总体系20uL,其中高效连接酶10.0uLpMG36c 质粒 3.5upL,I基因片段6.5uL摇匀, 水浴 30min 。
1.4重组质粒转化MG1363菌株
1.4.1重组质粒。 5uL与80uL感受态细胞混匀,加入mathrm预冷电转化杯,电激,程序为 2.5kV,200,25u, 。向电转化杯中加入920uL LB 培养基,移至离心管中 静置培养 0.5~1.0h 。浓缩菌液,涂布含 Cm 的LB固体培养基, 培养,筛选转化子。
1.4.2转化子验证。菌落PCR反应体系: 2×Es Taq Master-mix菌液 8uL,OPRI-F和OPRI-R( 10pmoluL})均1uL扩增条件 90s ,共30个循环,最后 延伸 5min 。
1.4.3转化子重组质粒提取与酶切验证。方法同"1.3.3”。
1.4.4转化子重组质粒测序验证。以P32-F为测序引物,对提取得到的重组质粒进行测序验证。测序结果由北京睿博兴科生物技术有限公司提供,利用Snapgene软件进行序列对比。
1.5重组菌株OprI蛋白表达检测重组菌株和MG1363菌株菌体超声破碎后SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,分离胶 15% 、浓缩胶 5% ;染色,凝胶脱色。
1.6重组载体疫苗安全性、异常毒性试验
1.6.1疫苗制备。重组菌株按 1% V/V比例接种含 cm 的GM17液体培养基, 30% 培养 至1.0,离心收集菌体,PBS溶液洗涤2次,制成浓度 (20 CFU/mL 菌悬液, 保存。
本文为全文原貌 未安装PDF浏览器用户请先下载安装
原版页码:ankx20250715.pd原版全文