体外模拟消化对鲟鱼头硒螯合肽结构及抗氧化活性的影响
作者: 贾娇 吴汶飞
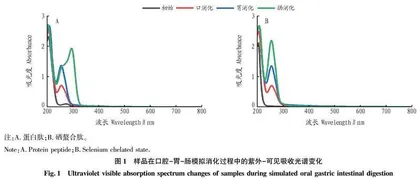
摘要为了明确鲟鱼头蛋白肽和鲟鱼头硒螯合肽的抗氧化活性差异,体外模拟了口腔及胃肠道消化处理过程中鲟鱼头蛋白肽和鲟鱼头硒螯合肽的结构及抗氧化活性变化。结果表明:鲟鱼头硒螯合肽的紫外光谱吸收峰在体外口腔胃肠模拟消化过程中比鲟鱼头蛋白肽更加稳定。体外模拟消化导致鲟鱼头蛋白肽和鲟鱼头硒螯合肽的圆二色谱吸收峰强度显著降低。粒径分布结果也表明:鲟鱼头硒螯合肽在消化过程中具有更好的溶解性。ABTS、DPPH以及OH自由基清除活性结果显示,在体外模拟消化后,鲟鱼头蛋白肽和鲟鱼头硒螯合肽的自由基清除活性进一步增强,且鲟鱼头硒螯合肽的自由基清除能力最强。
关键词鲟鱼头蛋白肽;硒螯合肽;结构特性;体外模拟;抗氧化活性
中图分类号TS254 文献标识码A 文章编号05176611(2024)07016905
doi:10.3969/j.issn.05176611.2024.07.040
Effects of in vitro Simulated Digestion on the Structure and Antioxidant Activity of Sturgeon Head Peptides-selenium
JIA Jiao1,2, WU Wen-fei1,2
(1.School of Food Science and Technology, Dalian Polytechnic University, Dalian, Liaoning 116034;2.National Engineering Research Center of Seafood, Dalian Polytechnic University, Dalian, Liaoning 116034)
AbstractIn order to clarify the difference in antioxidant activity of sturgeon head peptides and sturgeon head peptides-selenium, the structure and antioxidant activity changes of sturgeon head peptides and sturgeon head peptides-selenium during oral and gastrointestinal digestion were simulated in vitro. The results showed that the UV absorption peak of sturgeon head peptides-selenium is more stable than that of sturgeon head peptides during in vitro simulated oral gastrointestinal digestion. in vitro simulated digestion resulted in a significant decrease in the circular dichroism absorption peak intensity of sturgeon head peptides and sturgeon head peptides-selenium. The particle size distribution results also indicate that sturgeon head peptides-selenium has better solubility during digestion. The results of ABTS·+, DPPH· and ·OH scavenging activity showed that after simulated digestion in vitro, the free radical scavenging activities of sturgeon head peptides and sturgeon head peptides-selenium were further enhanced, and sturgeon head selenium-chelating peptide had the strongest free radical scavenging ability.
Key wordsSturgeon head peptides;Selenium-chelating peptides;Structural characteristics;in vitro simulation;Antioxidant activity
鲟鱼(Sturgeon)隶属于鲟形目硬骨鱼纲[1],是目前地球上最古老的软骨硬鳞鱼类之一[2]。鲟鱼营养价值极其丰富,富含各种氨基酸、不饱和脂肪酸和胶原蛋白,营养价值远高于畜禽类[3],其中P、Ca、Na、K、Mg、Cl等矿物质含量高达2%[4],蛋白含量高达21%[5],是优质蛋白的重要来源,其药用价值和保健功能在很多水产品之上[4]。近些年,随着鲟鱼年产量的逐年递增[6],有关其加工副产物的综合利用与高值化也备受关注。鲟鱼头是鲟鱼加工过程中的主要下脚料,在加工过程中被直接丢弃,造成了资源的浪费,其优质的营养物质也未被开发利用。
作为一种基本的微量营养元素,硒在人体中起着至关重要的作用。硒可以抑制多种致癌因子,从而起到辅助防癌抗癌作用,被称为“抗癌之王”。硒在我国分布十分不均衡,大约有22个省、72%的县处于缺硒或低硒状态[7]。人体缺硒会导致40余种疾病,如糖尿病、肾病、肿瘤、癌变、风湿性关节炎、白内障、贫血等[8],还会导致克山病、大骨节病等地方性疾病[9],孕妇缺硒还会导致胎儿发育受损[10]。适量补硒可以显著减少癌症和其他多种疾病的发生率。目前国内外关于蛋白肽与Fe、Zn、Ca等矿物质离子制备矿物质螯合肽的研究较多,但关于硒螯合肽的研究较少,因此还有极大的空间可以探求。以鲟鱼头为原料制备肽硒螯合物,研究其体外模拟消化过程中的结构变化和抗氧化活性,在充分利用海洋下脚料资源的同时,可为开发食源性硒补充剂及抗氧化肽提供了新的思路。
1材料与方法
1.1原料与试剂
鲟鱼头,衢州鲟龙水产食品科技开发有限公司。
胃蛋白酶,美国Sigma公司;人工唾液消化液,上海源叶股份有限公司;维生素E类似物(Trolox),北京百奥莱博科技有限公司;亚硒酸钠、盐酸、碳酸二氢钠、碳酸氢二钠、水杨酸、硫酸亚铁、H2O2、DPPH、ABTS等试剂均为分析纯。
1.2仪器与设备
SP1702紫外可见光谱仪,美国Perkin Elmer股份有限公司;Spectrum 10傅里叶变换红外光谱仪,美国Perkin Elmer有限公司;J1500圆二色谱仪,JASCO日本分光公司;ZS90激光粒度仪,英国马尔文仪器有限公司。
1.3鲟鱼头硒螯合肽的制备
根据宫民等[11]的研究方法提取得到鲟鱼头蛋白,并利用胃蛋白酶在37 ℃、pH 2的条件下酶解120 min,制备得到鲟鱼头蛋白水解产物。随后将0.5 mol/L亚硒酸钠溶液和3%(W/V)鲟鱼头蛋白水解液以体积比1∶2充分混匀,以制备鲟鱼头硒螯合肽,调节pH至90。随后在80 ℃水浴中反应1 h,冷却至室温,离心后取上清液并加入上清液体积5倍的95%乙醇溶液,混合均匀后静置沉淀12 h,离心后收集沉淀。最后用少量无水乙醇洗涤沉淀,以除去未结合上的硒,将沉淀冻干后得到鲟鱼头硒螯合肽,备用。
1.4鲟鱼头硒螯合肽的口腔胃肠模拟消化
口腔胃肠模拟消化方法参考金子琪等[12]的研究方法,配制模拟消化液。首先取20 mg样品溶于20 mL蒸馏水中,放入37 ℃水浴中预热,接着与20 mL人工唾液混合,调节pH至6.8,在37 ℃ 100 r/min下恒温振荡10 min,以模拟口腔消化。将口腔消化后得到的产物用1 mol/L HCl将pH调节至2.0,添加3.75 μL模拟胃消化液,消化90 min以模拟胃消化过程。继续用1 mol/L NaHCO3调节pH至7.5,加入13.125 μL模拟肠消化液,消化120 min以模拟肠消化过程。
1.5紫外可见吸收光谱测定
将冻干后的鲟鱼头蛋白肽和鲟鱼头硒螯合肽分别溶解在浓度为0.1 mg/mL去离子水中。用紫外可见分光光度计记录鲟鱼头蛋白肽和鲟鱼头硒螯合肽在200~800 nm波长范围内的紫外可见光谱。
1.6圆二色谱测定
将1 mg/mL鲟鱼头蛋白肽和鲟鱼头硒螯合肽分别放置于光程为0.1 cm的石英试管中,使用Jasco J1500圆二色光谱仪在190~260 nm波长下以1 nm/s速度重复扫描3次。扫描温度为(25±0.2) ℃。
1.7粒径测定
将鲟鱼头蛋白肽和鲟鱼头硒螯合肽溶于去离子水中,配制成1 mg/mL溶液,利用激光粒度仪进行测量。
1.8体外抗氧化活性研究
1.8.1
ABTS自由基清除活性测定。
根据Ketnawa等[1314]的方法,将 ABTS水溶液(7 mmol/L)和过硫酸钾溶液(140 mmol/L)以1∶1的比例混合并摇匀,在室温下避光反应12~16 h形成ABTS自由基溶液,用PBS缓冲液(0.2 mol/L,pH 7.4)稀释,使其在734 nm处的吸光值为0.70±0.02。将样液与ABTS自由基溶液混合后于30 ℃下避光反应6 min,反应结束后在734 nm处测定吸光值,以As表示,用蒸馏水替代稀释后的样品溶液作为空白组,其吸光值以A0表示。按以下公式计算ABTS自由基清除活性:ABTS自由基清除率=[(A0As)/A0]×100%。配制0、1、2、3、4、5 mmol/L浓度梯度的Trolox代替样液,重复上述样品测定操作绘制标准曲线,结果表示为mol TEAC/100 g DW。
1.8.2DPPH自由基清除活性测定。
根据章银良等[15]的方法,取1 mL样品溶液和3 mL DPPH(0.04 mg/mL)溶液于5 mL的EP管中,混合均匀后室温下避光反应30 min,用酶标仪在517 nm处测定吸光度,记为As。以相同的方法取1 mL蒸馏水代替稀释后的样品溶液作为空白组,测得的吸光度记为A0。按以下公式计算DPPH自由基清除率:DPPH自由基清除率=[(A0As)/ A0]×100%。按照上述样品反应步骤,配制0、1、2、3、4、5 mmol/L浓度梯度的Trolox标准溶液制作标准曲线。最终结果以mmol TEAC/100 g DW表示。
1.8.3
OH自由基清除活性测定。
根据马勇等[16]的方法,在2 mL EP管中依次加入100 μL FeSO4溶液(9 mmol/L)、100 μL乙醇水杨酸溶液(9 mmol/L),接着加入1 mL样液,最后加入100 μL H2O2(8.8 mmol/L),混合摇匀后于37 ℃干浴器内避光反应15 min。反应结束后用酶标仪测定其在510 nm处的吸光度,记为As,以相同的方法取1 mL蒸馏水代替稀释后的样品溶液作为空白组,在510 nm处测定其吸光度,记为A0。按以下公式计算OH自由基清除率:OH自由基清除率=[(A0As)/A0]×100%。按照上述样品反应步骤,配制0、1、2、3、4、5 mmol/L浓度梯度的Trolox标准溶液,按上述样品反应步骤制作标准曲线,结果表示为mmol TEAC/100 g DW。
1.9统计学分析方法
所有试验结果均以3个独立试验的平均值±标准偏差来表示,并用SPSS 18.0统计学软件(SPSS Inc,Chicago,IL)进行单因素方差分析(Oneway AVOVA)。不同的标记字母表示数据间存在显著差异(P<0.05)。