陈化粮对雏鸡生长性能和免疫指标的影响及乳酸杆菌的恢复作用
作者: 冷长友 孙浩 陈乐 舒丽 程依林 曹礼静 王庆华
摘要 在模拟制备黄曲霉毒素超标陈化粮的基础上,探究陈化粮对雏鸡料肉比、免疫器官指数和血细胞数量的影响以及乳酸杆菌的恢复作用。选用160只白来航雏鸡,随机分为4组,分别为对照组、高剂量黄曲霉毒素组、低剂量黄曲霉毒素组、高剂量黄曲霉毒素+乳酸杆菌组,攻毒时间为28 d。结果发现,与对照组相比,黄曲霉毒素对雏鸡日增重有显著的阻滞作用;与对照组相比,低剂量黄曲霉毒素组和高剂量黄曲霉毒素组料肉比极显著升高,而添加乳酸杆菌对雏鸡料肉比具有显著的恢复作用(P<0.05)。与对照组相比,黄曲霉毒素对鸡血细胞生成和免疫器官发育具有显著的阻滞作用(P<0.05),导致血细胞合成受阻和免疫器官发育滞后,而乳酸杆菌对鸡血细胞生成和免疫器官发育具有一定的恢复作用。
关键词 黄曲霉毒素;料肉比;血细胞数量;免疫器官指数;鸡;乳酸杆菌
中图分类号 S 831 文献标识码 A
文章编号 0517-6611(2024)12-0084-04
doi:10.3969/j.issn.0517-6611.2024.12.017
Effects of the Growth Performance and Immune Indices of Chicks and the Recovery Effect of Lactobacillus sp.
LENG Chang-you1,SUN Hao2,CHEN Le2 et al
(1.Vocational Education Center of Rongchang District in Chongqing,Chongqing 402460;2.College of Veterinary Medicine,Southwest University,Chongqing 402460)
Abstract Based on simulating the preparation of aged diet with excessive aflatoxin,the effects of aged diet on the feed-meat ratio,immune organ indexes and blood cell count of chicken,and the recovery effect of Lactobacillus sp.were studied.Thirty-six white Laihang Chicken were randomly divided into 4 groups:control group,high-dose aflatoxin group,low-dose aflatoxin group,high-dose aflatoxin+Lactobacillus sp. group,the test period was 28 days.The results showed that compared with the control group,aflatoxin had a significant retardation effect on the daily weight gain of chicken.Compared with the control group,the feed-meat ratio in the low-dose aflatoxin group and high-dose aflatoxin group significantly increased.Adding Lactobacillus sp. had a significant improvement effect on the feed-meat ratio (P<0.05).Compared with the control group,aflatoxin had a significant retardation effect on the formation of chicken blood cells and the development of immune organs (P<0.05),resulting in the blocked synthesis of blood cells and delayed development of immune organs,while Lactobacillus sp. had some recovery effects on the formation of chicken blood cells and the development of immune organs.
Key words Aflatoxin;Feed-meat ratio;Blood cell count;Immune organ index;Chicken;Lactobacillus sp.
基金项目 中国农村专业技术协会重庆荣昌肉兔科技小院项目;重庆市教委重大项目(KJZD-M202200202)。
作者简介 冷长友(1972—),男,重庆人,高级讲师,从事临床兽医学研究。*通信作者,副教授,博士,从事临床兽医学研究。
收稿日期 2023-07-13
黄曲霉菌(又叫黄曲菌,Aspergillus flavus)是常见腐生霉菌,属于真菌门半知菌亚门丛梗孢科曲霉属。黄曲霉菌广泛分布于世界各地,特别是温暖湿润地区[1]。黄曲霉菌极易在粮食、肉食奶制品、饲料和油料饲料中滋生,常常导致鸡出现食欲废绝、下血痢、皮肤贫血变白或黄疸、料肉比增加的现象,给养殖户造成极大的经济损失[2]。黄曲霉毒素(aflatoxins)是由黄曲霉或者其他曲霉菌产生的一种双呋喃环类毒素,动物因采食这些被黄曲霉毒素污染的食物或其加工副产品,在肠道内被吸收或者刺激肠道而发病[3]。
乳酸杆菌作为革兰氏阳性菌(G+),呈现单个、成双或短链排列,喜欢厌氧环境,因此容易寄生在各种动物的口腔、肠道及阴道中[4]。乳酸杆菌具有将碳水化合物合成葡聚糖和杂多糖并产酸的特征,是动物机体中的常见微生物菌群之一,对于在厌氧发酵环境下给动物提供营养和维持动物健康具有重要作用[5]。乳酸杆菌对鸡生长性能、免疫功能和抗氧化功能以及肠道菌群的维护具有重要作用。宋丹等[6]研究发现乳杆菌和屎肠球菌具有促进肉鸡生长、提高免疫力的作用。王雪莹等[7]研究发现饲喂乳酸杆菌后胃黏膜定殖大量的乳酸杆菌,可以拮抗病原微生物(幽门螺杆菌、霍乱沙门氏菌)对机体的危害。
陈化粮是指长期储存(存储3年及以上)的食物或饲料,因此陈化粮中黄曲霉菌及黄曲霉毒素往往会超标[8],此外陈化粮变质腐烂,糖类、脂肪和蛋白质等营养成分流失,已不能直接作为人类或动物的食物或饲料[9]。为了解决“三农”问题,各地粮仓敞开收购,导致粮仓爆仓,但因粮仓周转不灵导致粮食储存过久,从而导致出现大量的“陈化粮”[8]。笔者探讨添加乳酸杆菌后部分替代动物日粮,以降低养殖成本和提高经济效益,将陈化粮有限度地在部分肉鸡和蛋鸡养殖场使用。
笔者从市场购买的陈化粮中分离提取黄曲霉菌株,培养其产生的黄曲霉毒素后给试验鸡饲喂,研究其对试验鸡生长性能和免疫指标的影响,探讨不同添加量的乳酸杆菌对饲喂黄曲霉毒素污染饲料鸡料肉比、血细胞数量和免疫器官指数的影响,旨在为陈化粮的合理开发提供科学依据,也为乳酸杆菌在饲料中的合理添加提供技术支持。
1 材料与方法
1.1 试验材料
1.1.1 试验动物及其分组。选取160只5日龄白来航鸡,随机分为4组,分别为高剂量黄曲霉毒素组、低剂量黄曲霉毒素组、高剂量黄曲霉毒素+乳酸杆菌组、对照组,每组5个重复。每天定时对雏鸡进行饲喂并记录试验数据。试验鸡饲养于西南大学动物医学院动物饲养室。各组试验鸡隔离正常饲养,采食和饮水自由。试验结束后,白来航鸡被麻醉致死。该研究通过了西南大学实验动物福利伦理审查(伦理审查号为IACUC-20200701-01)。
1.1.2 菌种。乳酸杆菌由陕西科技大学钱卫东博士赠送,每天给鸡灌饲的乳酸杆菌量为7×1010 CFU/只。
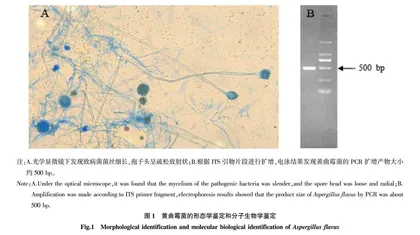
1.1.3 黄曲霉毒素的来源。将市场购买陈化粮中的黄色或黄绿色菌落置于显微镜下观察,发现霉菌菌丝呈分隔状,霉菌分生孢子梗表面粗糙,且小梗上分生孢子呈链状生长。将陈化粮中的黄色菌落接种于察氏培养基上,置于恒温培养箱中30 ℃培养3~5 d。待霉菌长出后,使用划线法分离黄曲霉菌,将黄曲霉菌纯化后培养黄曲霉毒素。
1.1.4 黄曲霉毒素含量的测定。采用超高效液相色谱-串联质谱法[10]测定基础日粮与试验陈化粮中黄曲霉毒素B1的含量。试验饲料使用84%乙腈水溶液提取,经过纯化稀释后上机测定。
1.1.5 不同黄曲霉毒素含量的陈化粮制备。首先,参考NRC(1994年)肉鸡饲养标准,配制基础日粮(饲料配方:玉米55.10%、豆粕37.20%、大豆油3.68%、碳酸氢钙1.71%、石粉1.32%、氯化钠0.30%、氯化胆碱0.15%、预混料0.25%、DL-蛋氨酸0.25%、L-赖氨酸盐酸盐0.03%、L-苏氨酸0.01%)。黄曲霉毒素超标的陈化粮和基础日粮按不同比例混合后,制备低剂量黄曲霉毒素组陈化粮(AFB1含量100 μg/kg)、高剂量黄曲霉毒素组陈化粮(AFB1含量200 μg/kg),饲喂试验鸡。在饲喂上述高剂量黄曲霉毒素组陈化粮的鸡只每日灌服乳酸杆菌7×1010 CFU/只,用于探讨乳酸杆菌的恢复作用。
1.1.6 主要仪器。恒温培养箱(型号GNP-9050)购自上海精宏设备有限公司;PCR仪(型号Mastercycler nexus X2 PCR)购自德国Eppendorf公司;电子天平(型号EL3 002型)购自梅特勒-托利多有限公司;血液分析仪(型号PE-6 800VET)购自武汉科尔达医疗科技有限公司;凝胶成像系统(型号GEL DOC XR)购自北京赛百奥科技有限公司;电泳仪(型号JY-300C)购自北京君意东方电泳设备有限公司;Acquity TQ-XS超高效液相色谱-三重四级杆质谱联用仪购自美国Waters公司。
1.1.7 主要试剂。标准黄曲霉毒素B1(98%),购自成都格利普生物科技有限公司;真菌DNA提取试剂盒,购自天根生化科技(北京)有限公司;察氏培养基,由笔者所在实验室配制;乳酸棉酚蓝染液,购自北京索莱宝科技有限公司。
1.2 试验方法
1.2.1 菌株形态学鉴定。采用透明胶带镜检法[11]进行菌株形态学鉴定,将乳酸酚棉蓝染液滴加于载玻片上,用食指和拇指将透明胶带弯折成“U”形,胶面朝下,轻轻蘸取部分菌落表面,浸入载玻片的乳酸酚棉蓝染液中并开始镜检,同时与《真菌医学:检验与图解》[12]进行对比,从形态学上进行初步鉴定。
1.2.2 菌株分子生物学鉴定。挑取菌落纯培养物,用真菌DNA提取试剂盒提取察氏培养基中培养48 h的霉菌DNA。根据真菌5.8S rDNA 间隔序列ITS引物(ITS-600-F为TCCGTAGGTGAACCTGCG,ITS-600-R为TCCTCCGCTTATTGATATGC),进行PCR扩增。PCR反应体系(25.0 μL)如下:2.0 μL DNA模板,10 μmol/L正、反向引物各2.0 μL,12.5 μL Taq PCR Master Mix,加入6.5 μL ddH2O补足25.0 μL。扩增程序如下:94 ℃预变性4 min;94 ℃变性30 s;55 ℃退火30 s;72 ℃延伸1 min,35个循环;72 ℃延伸10 min。对PCR扩增产物进行2%琼脂糖凝胶电泳,观察条带大小,并送交生工生物工程(上海)股份有限公司测序。使用BLAST程序,将测序结果与GenBank数据库中已有的基因序列进行同源性比对,进行分离菌株鉴定。