氟苯尼考胁迫对土壤解磷菌解磷能力的影响
作者: 陶松若 廖翠怡 彭金菊 张腾月 戴悦 马驿
摘要 从土壤中分离得到10株解磷菌,将菌株接种至LB液体培养基中,30 ℃培养24 h作为种子液。在无机磷液体培养基中加入氟苯尼考,使培养基含药浓度分别为0、0.1、1.0、10.0、50.0 μg/mL。按照1%的接种量接种种子液,30 ℃培养5 d,每24 h取2 mL培养液,利用钼锑抗分光光度法测定培养液中速效磷含量。结果表明,10株解磷菌在50.0 μg/mL药物浓度下,培养基中速效磷含量明显低于其他药物浓度组;大部分菌株在药物浓度0~50.0 μg/mL菌液中细菌数量变化不明显。说明氟苯尼考对解磷菌的解磷能力产生了抑制作用,但与细菌的生长繁殖并无明显相关性。
关键词 解磷菌;氟苯尼考;解磷能力
中图分类号 X171.5 文献标识码 A
文章编号 0517-6611(2023)04-0054-04
doi:10.3969/j.issn.0517-6611.2023.04.013
Effect of Florfenicol Stress on Phosphate-solubilizing Ability of Soil Phosphate-solubilizing Bacteria
TAO Song-ruo,LIAO Cui-yi,PENG Jin-ju et al
(Department of Veterinary Medicine,College of Coastal Agricultural Sciences,Guangdong Ocean University,Zhanjiang,Guangdong 524088)
Abstract 10 phosphate-solubilizing bacteria were isolated from soil,inoculated into LB liquid medium,and cultured at 30 °C for 24 h as seed solution.Florfenicol was added to the inorganic phosphorus liquid medium,and the drug concentrations in the medium were 0,0.1,1.0,10.0 and 50.0 μg/mL,respectively.Seed solution was inoculated with 1% inoculum,cultured at 30 °C for 5 d,and 2 mL culture medium was taken every 24 h.The content of available phosphorus in culture medium was determined by molybdenum antimony anti-spectrophotometry.The results showed that the content of available phosphorus in the medium of 10 phosphate-solubilizing bacteria at 50.0 μg/mL was significantly lower than that of other drug concentrations.Most of the strains in the bacterial solution with drug concentration range of 0-50.0 μg/mL,the number of bacteria did not change significantly.This indicated that florfenicol inhibited the phosphate-solubilizing ability of phosphate-solubilizing bacteria,but had no significant correlation with the growth and reproduction of bacteria.
Key words Phosphate-solubilizing bacteria;Florfenicol;Phosphate-solubilizing ability
土壤环境中存在着大量具有解磷能力的微生物,能够将难溶性磷酸盐转化为植物可吸收利用的磷素[1]。据研究报道,施入解磷菌群能有效提高土壤中的有效磷、全磷含量以及碱性磷酸酶活性,进而促进油菜的生长发育,其中细菌的促进效果最明显[2]。将解磷菌制成解磷菌肥施入土壤能提高玉米株高、氮磷含量,增加土壤的可溶性磷含量[3]。此外,解磷微生物释放的磷素还可以降低土壤中重金属的活性,减弱因外部环境使用含磷物质而导致的污染[4]。
氟苯尼考为动物专用抗生素,广泛应用于动物细菌性疾病的防治[5]。氟苯尼考进入动物机体后,一部分药物会在动物体内残留,另一部分药物及其代谢物随着动物排泄物进入土壤中,给生态环境带来污染[6]。抗生素进入土壤环境中能影响土壤微生物群落功能多样性[7]。目前,有关氟苯尼考对解磷菌解磷能力的影响鲜见报道。该试验利用钼锑抗分光光度法,测定解磷菌在不同浓度氟苯尼考的条件下培养解磷能力之间的差异,旨在为氟苯尼考在环境中残留对环境微生物产生的生态毒理影响提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试土壤。
采自广东海洋大学校内菜地,经检测不含氟苯尼考。土壤理化性质:pH 5.42、碱解氮22.16 mg/kg、全氮0.55 g/kg、速效磷46.80 mg/kg、速效钾263.25 mg/kg、有机质10.97 g/kg、盐度88 μS/cm。
1.1.2 药品与试剂。
氟苯尼考(含量98%,山东国邦药业有限公司,批号701-2005101);LB液体培养基、固体培养基(北京路桥技术股份有限公司);无机磷固体培养基(青岛海博生物技术有限公司);无机磷液体培养基(北京酷来搏科技有限公司);抗坏血酸、酒石酸锑钾、钼酸铵、KH2PO4(上海易恩化学技术有限公司);无水乙醇、浓H2SO4均为分析纯;氟苯尼考药液(ρ=1 mg/mL):称取0.05 g的氟苯尼考粉末,加入无水乙醇溶解,完全溶解后移入50 mL容量瓶中,用蒸馏水稀释至刻度线。
1.1.3 钼锑抗分光光度法试剂。
钼锑抗分光光度法所需试剂参照王明欢等[8]的方法进行配制。①10%抗坏血酸:将10 g抗坏血酸(AR)用少量蒸馏水溶解后定容至100 mL,用棕色瓶保存于4 ℃。
②13%钼酸铵溶液:将13 g钼酸铵(AR)用少量蒸馏水溶解后定容至100 mL。
③0.35%酒石酸锑钾溶液:将0.35 g酒石酸锑钾(AR)用少量蒸馏水溶解后定容至100 mL。
④硫酸溶液:将150 mL的浓硫酸(AR)用玻璃棒缓缓引流入150 mL蒸馏水中,配制成300 mL的硫酸溶液。
⑤钼酸盐溶液:将13%钼酸铵溶液用玻璃棒引流徐徐加入硫酸溶液中,再用玻璃棒搅拌充分混匀,待溶液冷却后再缓缓加入0.35%酒石酸锑钾溶液,冷却后储存在棕色玻璃瓶中于4 ℃保存。
⑥磷酸盐储备溶液(ρ=100 mg/L):称取0.439 0 g KH2PO4经105 ℃烘干2 h后溶于200 mL蒸馏水中,加入5 mL(1+1)浓硫酸,转入1 000 mL容量瓶中,用蒸馏水定容至刻度。
⑦磷酸盐标准使用液(ρ=5 mg/L):量取5 mL 的磷酸盐储备溶液于100 mL容量瓶中,用蒸馏水定容至刻度,现配现用。
1.1.4 主要仪器。
可调微量移液器(Eppendorf,德国);生化培养箱(SPX-250,上海福絮实验室仪器设备厂);不锈钢手提式灭菌器(DSX-280B,上海沪粤明科学仪器有限公司);超净工作台(SW-CJ-1D,上海博迅实业有限公司医疗设备厂);电子天平(JJ323BC,常熟市万杰测试仪器厂);台式恒温摇床(TS-100C,金坛市精达仪器制造有限公司);可见分光光度计(V-1000,上海翱艺仪器有限公司)。1.2 方法
1.2.1 解磷菌的分离培养。
称取土壤样品用蒸馏水稀释制备浓度适合的菌悬液,吸取菌悬液于无机磷固体培养基上,均匀涂布,30 ℃培养72 h。挑取具有明显、透明溶磷圈的单一菌落,接种于LB液体培养基,30 ℃,180 r/min摇床振荡培养24 h后加30%甘油于-20 ℃保存。采用DNA提取试剂盒提取细菌基因组并扩增16S rDNA片段,将扩增产物送至生物公司测序,测序结果在NCBI上Blast后对比分析。
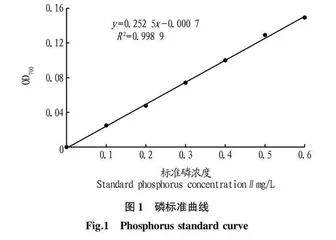
1.2.2 绘制磷标准曲线。
分别吸取5 mg/L磷标准贮备液0、1、2、3、4、5、6 mL于50 mL容量瓶中,用蒸馏水定容至刻度,得到0.1、0.2、0.3、0.4、0.5、0.6 mg/L系列标准磷溶液,加入1 mL 抗坏血酸,充分混匀后加入2 mL钼酸盐,显色20 min后用分光光度计读取700 nm的吸光度。以蒸馏水作为参照,标准磷浓度作为横坐标、OD700值作为纵坐标绘制标准曲线。
1.2.3 磷含量测定。
将菌株接种至LB液体培养基中,30 ℃培养过夜,作为种子液。于50 mL无机磷液体培养基中加入氟苯尼考使培养基中含药浓度分别为0、0.1、1.0、10.0、50.0 μg/mL,按照1%的接种量将种子液加入药物培养基中,加入等体积的蒸馏水作为空白对照,每组3个重复;在30 ℃的条件下,160 r/min摇床振荡5 d,每24 h取2 mL培养液10 000 r/min离心10 min,取1 mL上清液移入50 mL 容量瓶中,用蒸馏水定容至刻度线,加入1 mL抗坏血酸,充分混匀后加入2 mL钼酸盐溶液,显色20 min后用分光光度计读取700 nm的吸光度。可溶性磷含量(mg/L)的计算公式为P=K×V/V1,式中,P为可溶性磷含量;K为从标准曲线得到的速效磷含量(mg/L);V为显色液总体积(mL);V1为上清液体积(mL)[9]。
1.2.4 细菌浓度测定。
于培养的第5天量取细菌培养液,用LB液体培养基稀释到适合的浓度。吸取不同浓度的细菌悬
液各10 μL涂布于LB固体培养基上,30 ℃培养72 h,之后选取菌落长势良好的平板进行细菌计数,菌液浓度计算公式:菌液浓度(CFU/mL)=(菌落数×稀释度)/0.01。
1.3 数据统计与处理
用Origin 2021函数绘图软件整理数据并作图;试验数据采用IBM SPSS Statistics 23统计分析软件进行解磷菌溶磷含量的差异显著性分析。
2 结果与分析
2.1 解磷菌16S rDNA鉴定结果 测序结果经Blast后对比分析,分离的10株土壤优势解磷菌主要为伯克霍尔德菌属、罗尔斯顿菌属和窄食单胞菌属细菌。
2.2 磷标准曲线的绘制 从图1可以看出,磷标准溶液浓度及对应的吸光度的标准曲线方程为y=0.252 5x-0.000 7(R2=0.998 9),表明线性回归良好。
2.3 磷含量
将从土壤中分离出的10株解磷菌于不同浓度氟苯尼考的条件下培养,每24 h测量其培养液中的速效磷含量,选取最具代表性的培养时间的测定值绘制曲线图,10株解磷菌在不同药物浓度下的溶磷效果见表1。从表1可以看出,10株解磷菌在50.0 μg/mL药物浓度下,培养基中速效磷含量明显低于其他药物浓度组。其中,菌株P64、P33、P51、P53、P32、P42的溶磷含量随药物浓度的增加逐渐下降,与药物浓度呈反比;菌株P35、P93在药物浓度为0~0.1 μg/mL时,溶磷含量上升,药物浓度为>0.1~50.0 μg/mL时,溶磷含量下降;而菌株P62、P13并没有表现出规律的溶磷效果,P13的溶磷效果波动较大。