基于DIA LC-MS的高淀粉型与低淀粉型粉葛叶片的定量蛋白质组学差异
作者: 黄琦 程建峰 朱卫丰 褚怀亮 赵文峰 葛菲 吴波 丁立军 张建华 余聪
摘要 [目的]寻求粉葛生长发育的蛋白调控机制。[方法]以高淀粉型赣葛1号(鲜葛根含淀粉20%,干葛根含淀粉35%)和低淀粉型赣葛2号(鲜葛根含淀粉14%,干葛根含淀粉25%)为材料,采用基于全扫描数据非依赖性采集高分辨率色谱-质谱(DIA LC-MS)的定量蛋白质组学技术得到差异蛋白质,并对差异蛋白进行GO富集、KEGG通路和KOG分析。[结果]2个不同粉葛叶片中有178个蛋白(101个上调和77个下调)存在显著差异,主要涉及分子功能,但|log2(FC)|>5.0的差异蛋白仅占11.2%。GO富集分析表明,差异蛋白主要富集在代谢过程、催化活性、水解酶活性、细胞部分、细胞内部分、细胞质部分和细胞内细胞器类别。KEEG富集代谢途径集中在苯丙氨酸生物合成、植物体内的MAPK信号通路、次生代谢物生物合成、丙酮酸代谢和脂肪酸代谢。KOG分析显示,差异蛋白功能主要归为核苷酸转运和代谢、核糖体结构和生物发生、能量产生和转换、信号转导以及翻译后蛋白修饰、周转和伴侣机制。差异程度极大的蛋白依次为上调的类LHC Ⅱ型1叶绿素a-b结合蛋白、kunitz家族胰蛋白酶和蛋白酶抑制剂前体、凝集素类蛋白和几丁质酶同源物及下调的类溶酶体Pro-X羧肽酶、预测的类dCTP焦磷酸酶1、富含半胱氨酸的受体类蛋白激酶25和色氨酸转氨酶相关蛋白4。[结论]研究结果为粉葛的生长发育、营养成分和活性物质的合成及调控、遗传改良及分子育种等提供数据支撑和技术途径。
关键词 粉葛;高淀粉型;低淀粉型;定量蛋白组学;差异蛋白;DIA LC-MS
中图分类号 R284 文献标识码 A 文章编号 0517-6611(2023)14-0168-10
作者简介 黄琦(1984—),男,江西横峰人,高级农艺师,硕士,从事葛新品种选育及高产高效栽培利用研究。
*通信作者,教授,博士,博士生导师,从事植物生理生态研究。
粉葛(Pueraria thomsonii)是豆科葛属植物,多年生落叶藤本[1]。粉葛具有解肌退热、生津止渴、透疹、升阳止泻、通经活络、解酒毒之功效[2],目前常应用于临床治疗一些高血压、高血脂、高血糖。粉葛中含有大量的维生素和微量元素,用于治疗风热感冒、麻疹、痢疾、腹泻、吐血、尿血等疾病,还可以增加免疫功能和抗衰老,已被用于保健食品和生物医药等领域[3]。粉葛是我国传统的药食同源植物,其根为肉质,粗壮肥大,最丰富的营养物质为淀粉,为鲜重的15%~20%、干重的25%~35%,干重含量最高可达47%[4-5]。粉葛的葛根产量及淀粉含量与品种特性及栽培措施密切相关。张应等[4]研究表明,苕葛1号干重淀粉含量最高(46.39%),地金2号干重淀粉含量最低(29.92%),5—12月淀粉含量逐月增加;黄荣韶等[6]认为,保留3条根2条枝时,粉葛块根的淀粉含量最高;赵婧文等[7]研究表明,粉葛中的淀粉含量与葛根素含量呈显著负相关;顾彩霞[8]研究显示,云南地区野生葛根淀粉含量较高(12.12%~21.80%),河北地区淀粉含量较低(4.41%~10.86%),穴施25 g磷肥时粉葛淀粉含量显著提高了1.78倍,粉葛块根中淀粉含量与土壤中速效磷和速效钾含量呈显著正相关;朱盼等[9]研究发现,不同产地粉葛不同部位的化学成分含量差异较大,粉葛不同部位可以发挥药用、食用的不同作用,实现对其的综合利用;何明慧等[10]研究表明,粉葛块根中的淀粉含量随有机肥用量的增加呈先升后降的趋势,以6 000 kg/hm2较合适。但人们对粉葛中淀粉合成的内在调控机制研究较少,限制了粉葛品种的遗传改良和高淀粉含量的良种选育。
蛋白质是生命代谢活动的直接体现者,所有生命体性状表达功能均由蛋白质承担,随着众多植物基因组学和转录组学研究的不断深入,作为在蛋白质水平上解释基因表达调控机制的蛋白质组学是后基因组时代的重要研究领域,对蛋白质的功能分析、鉴定及翻译后修饰的研究将会极大地阐明基因功能,更加客观准确地揭示生命现象[11-13]。基于全扫描数据非依赖性采集高分辨率色谱-质谱(data independent acquisition liquid chromatography-mass spectrometry,DIA LC-MS)的定量蛋白质组学技术由蛋白质组学届Aebersold教授开创[14],该技术融合了传统蛋白质组学“鸟枪法”(shotgun)和质谱绝对定量“金标准”选择反应监测/多反应监测(SRM/MRM)技术的优势和特点,且DIA技术将质谱整个全扫描范围分为若干个窗口,高速、循环地对每个窗口中的所有离子进行选择、碎裂、检测,从而无遗漏、无差异地获得样本中所有离子的全部碎片信息,具有全景式动态扫描、更大的识别率、更高的重现性和灵敏度、更少的缺失值、数据可回溯等优势[15-18]。但DIA LC-MS技术也存在需要建立高质量的DIA蛋白光谱库、数据获取比较昂贵、数据分析相对复杂和需要一定的专业知识等不足[19-23],故目前主要用于生物医学和药学上[22-30],在植物上的应用较少。鉴于此,为揭示淀粉含量存在明显差异的2个粉葛品种叶片在蛋白水平的差异,该研究选取了高淀粉型赣葛1号(鲜葛根淀粉含量20%和干葛根含淀粉35%)和低淀粉型赣葛2号(鲜葛根淀粉含量14%和干葛根含淀粉25%)为材料,采用DIA LC-MS定量蛋白质组学技术来解析它们间的蛋白差异,为粉葛的生长发育、营养成分和活性物质的合成及调控、遗传改良及分子育种等提供数据支撑和技术途径。
1 材料与方法
1.1 供试材料
选用2个淀粉含量存在明显差异的粉葛品种,分别为高淀粉型赣葛1号(鲜葛根淀粉含量20%和干葛根含淀粉35%)和低淀粉型赣葛2号(鲜葛根淀粉含量14%和干葛根含淀粉25%),取样部位为主藤顶部功能叶,采自江西绿色生态葛研究所种植基地。
1.2 试验原理
试验共2组样品,3个生物学重复。将6个样品中提取的蛋白等量混合为一个新的样品进行建库,在这个基础上进行数据库检索,再通过数据依赖采集技术进行数据采集建库,之后将6个样品依次进行非数据依赖采集对样本进行相对定量分析。在准备样品期间,所有待测样品中都添加iRT肽段进行一定时间矫正和质谱峰提取。采集到的DIA数据通过Spectronaut 14软件进行数据归一化和蛋白质的相对定量,通过单向方差分析测试计算p值。
1.3 样品前处理
1.3.1 样品准备。
在液氮中进行样品研磨,随后加入2 mL细胞裂解液,于冰上超声裂解1 h后高速离心30 min(8 000 r/min,4 ℃)。加入等体积的Tris-HCl苯酚饱和溶液(pH 7.5),混合液于4 ℃摇匀(约30 min)。高速离心15 min(4 ℃,8 000 r/min),取上层酚相。重复萃取1次。加入5倍体积丙酮溶液于-20 ℃沉淀过夜。沉淀蛋白用丙酮溶液冲洗2次,冻干,用含1% SDS的8 mol/L尿素溶液重溶。
1.3.2 蛋白酶解。
将每种条件下100 μg蛋白质转移到新的艾本德(Eppendorf)管,用8 mol/L尿素将最终体积调节至100 μL。加入2 μL 0.5 mol/L TCEP,在37 ℃孵育1 h。然后向样品中加入4 μL 1 mol/L碘乙酰胺,在室温避光下持续孵育40 min。之后,在样品中加入5倍体积的-20 ℃预冷丙酮,在-20 ℃下过夜沉淀蛋白质。沉淀物用1 mL预冷的90%丙酮水溶液洗涤2次,然后重新溶解在100 μL 100 mmol TEAB中。以1∶50(酶∶蛋白质,质量比)的比例加入序列级修饰的胰蛋白酶,在37 ℃下过夜酶解蛋白质。肽混合物通过除盐柱除盐,通过皮尔斯肽段定量试剂盒测定其最终浓度并冻干。
1.4 建立数据库
1.4.1 高pH反相分离。
将肽段混合物在缓冲液A(20 mmol/L甲酸铵水溶液,用氨水调节pH至10.0)中重新溶解,然后用Ultimate 3000系统连接反向柱进行高pH分离,使用线性梯度进行高酸碱度分离,在40 min内缓冲液B(80%乙腈中加入20 mmol/L 甲酸铵,用氨水调节pH至10.0)从5%到45%。柱子在初始条件下重新平衡15 min,柱流速保持在1 mL/min,柱温保持在30 ℃。共收集到8个馏分,每个馏分在真空浓缩器中干燥,以便下一步操作。
1.4.2 Nano-HPLC-MS/MS分析。
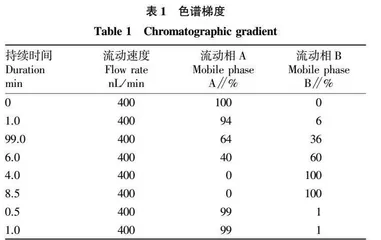
除盐冻干后的肽段被重新溶解在溶剂A(0.1%甲酸水溶液)中,由配备在线纳喷离子源的LC-MS/MS分析。色谱柱为C18(3 mm×50 mm×3 μm),进行120 min梯度分离。色谱梯度如表1所示,其中,流动相A为0.1%甲酸水溶液,流动相B为含0.1%甲酸的乙腈溶液。色谱柱流速维持在400 nL/min,电喷雾电压为2 kV。
1.4.3 搜库。
原始数据由Spectronaut 14(Biognosys AG)在默认设置下处理和分析,生成一个初始数据库,其中包含44 057个母离子、32 067个肽段、5 830个蛋白质和5 642个蛋白质组。搜库参数固定修饰为Carbamidomethyl(C),可变修饰为methionine氧化。母离子和肽段水平的假阳性率设置为1%。
1.5 DIA数据采集与分析
1.5.1 Nano-HPLC-MS/MS数据采集。
将肽段重新溶于溶剂A(0.1%甲酸水溶液)中,从中取出9 μL并加入1 μL 10×iRT肽段,混合后用nano-LC分离,再由在线电喷雾串联质谱分析。上样量为2 μL,进行120 min梯度分离,柱的流量保持在400 nL/min,采用2 kV的电喷电压。色谱梯度如表1所示,其中流动相A为0.1%甲酸水溶液,流动相B为含01% 甲酸的乙腈溶液。
1.5.2 数据分析。
1.5.2.1 差异表达蛋白筛选。
DIA的原始数据由Spectronaut 14(Biognosys AG)以默认设置参数进行处理和分析,保留时间预测类型设置为动态iRT。Spectronaut 14根据广泛的质量校准确定数据提取,且根据iRT校准和梯度稳定性动态确定理想的提取窗口。通过过滤器的所有选定前体都用于定量,除了3个干扰最小的离子外,MS2干涉将去除所有干扰碎片离子。经单因素方差分析后,如果某个蛋白表达的p值<0.05且差异倍数绝对值>1.5,则判定为差异表达蛋白。
1.5.2.2 差异蛋白GO分析。
使用Blast2GO version 5进行功能注释,采用GOATOOLS进行差异蛋白功能富集。GO分析根据三点(分子功能、细胞器组成和生物过程)注释和分类基因及其对应的产物来获取蛋白质的功能信息。GO分析后根据挑选出的差异基因,计算这些差异基因与GO 分类中某(几)个特定的分支的超几何分布关系,GO 分析会对每个有差异基因存在的GO 存在一个特定p值,p值越小表示差异基因在该GO 中富集程度越大。
1.5.2.3 差异蛋白KEGG分析。
通路分析使用KOBAS(http://kobas.cbi.pku.edu.cn/)进行。与GO分析类似,p值越小表示差异基因在该KEGG中富集程度越大。当p值小于某一个阈值时(一般设为0.05),认为该功能是可信的,同时根据p值进行错误发现率(FDR)校正计算后,获得校正后的p值,可根据实际需要选取p值或校正后的p值来判定可信度。