健康与患根腐病草莓根际•非根际与根内古菌群落多样性
作者: 戴瑞卿 赖宝春 吴振强 曾天宝 王家瑞
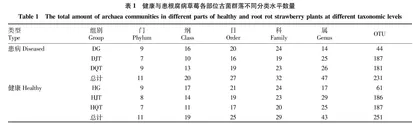
摘要 [目的]分析健康与患根腐病草莓根际土壤、非根际土壤及根内古菌群落结构与多样性。[方法]运用Illumina MiSeq高通量测序技术,分别对根际土壤、非根际土壤及根内古菌16S rRNA基因的V3~V4区进行扩增并测序,分析健康与患根腐病草莓不同部位古细菌群落结构与多样性。[结果]健康组共鉴定出11个门、19个纲、25个目、29个科、43个属,患根腐病组共鉴定出11个门、20个纲、27个目、32个科、47个属。门水平上,所有土壤样品的优势古菌门均为奇古菌门(Thaumarchaeota)、广古菌门(Euryarchaeota)和乌斯古菌门(Woesearchaeota),所有根内样品优势菌门均为奇古菌门和广古菌门;患根腐病草莓根际和非根际土壤的奇古菌门相对丰度均低于健康草莓,广古菌门和乌斯古菌门相对丰度均高于健康草莓,患根腐病草莓根内样品的奇古菌门和广古菌门相对丰度均低于健康草莓。属水平上,所有土壤样品的优势属均为亚硝化球菌属(Nitrososphaera)、亚硝化侏儒菌属(Nitrosopumilus)和Methanomassiliicoccus属,患根腐病草莓根际土壤亚硝化球菌属相对丰度比健康减少9.27百分点,非根际土壤亚硝化球菌属相对丰度比健康减少9.87百分点;所有根内样品的优势属均为亚硝化球菌属和甲烷孢菌属(Methanocella),亚硝化球菌属相对丰度比健康增加15.13百分点。[结论]健康与患根腐病草莓根际土壤、非根际土壤及根内样品古菌群落组成差异明显,说明草莓根腐病的发生与根际土壤、非根际土壤以及根内古菌群落结构改变密切相关。
关键词 草莓;根腐病;古菌群落结构;多样性;高通量测序
中图分类号 S 436.5文献标识码 A文章编号 0517-6611(2022)02-0147-04
doi:10.3969/j.issn.0517-6611.2022.02.039
开放科学(资源服务)标识码(OSID):
Archaea Community Diversity in Rhizosphere, Non-rhizosphere and Root Tissue of Healthy and Root Rot Strawberry Plants
DAI Rui-qing, LAI Bao-chun, WU Zhen-qiang et al
(Zhangzhou Institute of Agricultural Sciences of Fujian Province, Zhangzhou, Fujian 363005)
Abstract [Objective]To analyze the archaea community structure and diversity of healthy and root rot strawberry in rhizosphere soil, non-rhizosphere soil and root tissue.[Method]The V3-V4 region of the archaea 16S rRNA gene in rhizosphere soil, non-rhizosphere soil and root tissue was amplified, and the amplified fragments were sequenced by Illumina MiSeq high-throughput sequencing technology. [Result] Healthy and root rot strawberry group samples got 11 phyla, 19 classes, 25 orders, 29 families, 43 genera and 11 phyla, 20 classes, 27 orders, 32 families, 47 genera, respectively.Thaumarchaeota, Euryarchaeota and Woesearchaeota were the dominant phyla in all soil sample,Thaumarchaeota andEuryarchaeota were the dominant phyla in allroot tissue. Compared with healthy strawberry plants, the relative abundance of Thaumarchaeota inrhizosphere and non-rhizosphere soil of root rot strawberry plant was generally lower, Euryarchaeota and Woesearchaeota was generally greater.The relative abundance of Thaumarchaeota and Euryarchaeotain root tissue of root rot strawberry plant was generally lower than healthy plants. The dominant genera in all soil samples were Nitrososphaera,Nitrosopumilus and Methanomassiliicoccus.Nitrososphaera and Methanocella were the dominant genera in all root tissue samples.Compared with healthy strawberry plants, the relative abundance of Nitrososphaera in rhizosphere and non-rhizosphere soil was 9.27 and 9.87 percentage point lower, respectively,which in root tissue was 15.13 percentage point higher.[Conclusion] There were significant differences in archaea community composition of rhizosphere soil, non-rhizosphere soil and root tissue from healthy and rootrot strawberry. Occurrence of strawberry rootrot was closed to thevariation ofarchaea community structure in field soil and root tissue.
Key words Strawberry;Root rot;Archaea community;Diversity;High-throughput sequencing
基金项目 福建省科技计划项目(2019N0201)。
作者简介 戴瑞卿(1990—),女,福建漳浦人,研究实习员,硕士,从事植物病害综合防控研究。*通信作者,副研究员,硕士,从事植物病害综合防控研究。
收稿日期 2021-05-19
草莓具有较高的营养价值和经济价值,素有“水果皇后”之称[1]。据统计,1994—2016年,我国草莓种植面积和产量逐年增加,规模逐渐扩大,产量稳居世界首位[2]。随着产业的发展,草莓根部病害逐年加重,由土传病原真菌引起的根腐病是最重要的草莓根部病害之一[3]。根腐病类型多样、病原菌复杂,目前报道的草莓根腐病病原物已有20多种,如丝核菌属(Rhizoctonia)、镰刀菌属(Fusarium)、拟盘多毛孢属(Pestalotiopsis)、疫霉属(Phytophthora)等,是一种较难防治的土传病害,严重制约草莓产业的正常发展[4-7]。
土壤作为微生物群落的“种子库”,是植物内生菌的最初来源;土壤微生物作为生命元素循环的驱动者,主导和参与地下生态系统中一系列重要生态过程,对土壤能否正常有序地执行各项生态功能至关重要;根际作为植物-土壤生态系统物质交换的一个界面,是根系-土壤-微生物三者紧密结合并相互交流的场所;植物组织作为特化性更强的环境,与其共存的微生物群落、植物生长发育密切相关[8-10]。土壤和植物内生微生物的多样性能够影响植物病害的发生,微生物既可以通过养分竞争和拮抗作用等抑制病原菌的繁殖,促进植物生长,也可以通过病原菌的积累导致植株死亡[5]。因此,分析健康与患根腐病草莓根际土壤、非根际土壤及根内组织古菌群落结构和多样性的变化,对了解草莓根腐病发生的原因及提供相应的防治措施具有重要意义。高通量测序技术可以准确、全面地反映样本的微生物群落结构,该项技术已被广泛运用于土壤和植物内生微生物的研究[10]。笔者通过高通量测序技术分析健康与患根腐病草莓根际土壤、非根际土壤及根内组织古菌群落结构和多样性,了解草莓根腐病发生与古菌群落结构改变的关系,为探究草莓根腐病的发生机制、有效防控草莓根腐病提供科学依据。
1 材料与方法
1.1 样品采集
2020年3月,于福建省漳州市颜厝镇草莓种植基地(116°41′03″E,39°91′01″N),选取草莓根腐病暴发严重的草莓种植地进行样品采集。样品采集方法参照向立刚等[11]进行,患根腐病草莓植株根际土壤组样品编号为DJTa、DJTb、DJTc,患根腐病草莓植株非根际土壤组样品编号为DQTa、DQTb、DQTc,患根腐病草莓根内组样品编号为DGa、DGb、DGc;健康草莓根际土壤组样品编号为HJTa、HJTb、HJTc;健康草莓非根际土壤组样品编号为HQTa、HQTb、HQTc;健康草莓根内组样品编号为HGa、HGb、HGc。所有样品置入低温保藏箱,并迅速带回实验室,-80 ℃冰箱保存、备用。
1.2 样品DNA提取、PCR扩增和高通量测序
称取500 mg充分混匀的土壤样品,采用E.Z.N.ATM Mag-Bind Soil DNA Kit(OMEGA)提取土壤样品DNA。采用DNeasy Plant miniKit(Qiagen)提取根内样品DNA。利用Qubit 3.0荧光定量仪对DNA浓度精确定量。以样品DNA为模板,进行3轮PCR扩增,第一轮PCR引物为GU1ST-340F(5′-CCCTAYGGGGYGCASCAG-3′)和GU1ST-1000R(5′-GGCCATGCACYWCYTCTC-3′),PCR扩增体系为30 μL(15 μL 2×Hieff Robust PCR Master Mix,10 μmol/L的Primer F和Primer R各1 μL,10~20 ng DNA);第二轮PCR引物为V3~V4区通用引物349F(5′-GYGCASCAGKCGMGAAW-3′)和806R(5′-GGACTACVSGGGTATCTAAT-3′),PCR扩增体系为30 μL(15 μL 2×Hieff Robust PCR Master Mix,10 μmol/L的Bar-PCR Primer 341F和Primer R各1 μL,10~20 ng DNA);第三轮PCR扩增引入Illumina桥式PCR兼容引物,PCR扩增体系为30 μL(15 μL 2×Hieff Robust PCR Master Mix,10 μmol/L的Primer F和Index-PCR Primer R各1 μL,10~20 ng DNA)。PCR反应程序:94 ℃预变性3 min;5个循环(94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s),20个循环(94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s),72 ℃延伸5 min,10 ℃保存。PCR 产物采用琼脂糖试剂盒回收,用Qubit 3.0 DNA检测试剂盒对回收的DNA精确定量,按1∶1 等量混合后,采用Illumina公司的Hiseq 2500 平台测序进行高通量测序。
1.3 测序数据处理与分析
利用Cutadapt、PEAR(version 0.9.8)、PRINSEQ(version 0.20.4)等软件对Illumina Miseq测序获得的序列进行质控和过滤,得到各样本的高质量序列。利用Usearch软件(version 11.0.667),按照97%相似性对非重复序列(不含单序列)进行OTU聚类。采用RDP classifier贝叶斯算法(version 2.12)对97%相似度水平的OTU代表序列进行分类学分析,统计各个样品的菌落组成,绘制不同分类水平上古菌类群的相对丰度图。利用Mothur(version 1.43.0)软件计算各样本的Chao、Ace、Shannon、Simpson、Shannoneven 指数,分析样本古菌的Alpha 多样性。利用R软件绘制不同分类的相对丰度热图。