青岛莱西地区草莓根腐病菌鉴定及其拮抗木霉的筛选
作者: 王铃朝 毛洪朔 刘烨贝 刘天彪 梁锦燕 佘明君 张茹琴
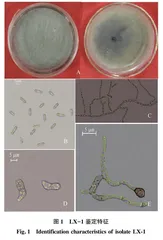
摘要 于2018—2019年从青岛莱西地区10个草莓种植基地的30个采样点共采集90份草莓根腐病病样,利用组织分离法对病原菌进行了分离,结合形态学和分子生物学鉴定以及致病性测定,以确定引起该地区草莓根腐病的病原菌种类,同时初步测试了4株木霉对病原菌的抑菌效果及抑菌机理。结果表明,共分离到6种真菌,分别为胶孢炭疽菌(Colletotrichum gloeosporioides)、尖孢镰刀菌(Fusarium oxysporum)、新棒状拟盘多毛孢(Neopestalotiopsis clavispora)、枝状枝孢(Cladosporium cladosporioides)、菌核生枝顶孢(Acremonium sclerotigenum)和土曲霉(Aspergillus terreus)。前三者为草莓根腐病菌,胶孢炭疽菌和尖孢镰刀菌的分离频度分别为45.8%和32.1%,是优势病原菌,新棒状拟盘多毛孢分离频度为8.4%。4株木霉通过竞争作用、产生非挥发性菌代谢产物抑制3种病原菌生长。培养3 d时,4株木霉代谢产物对3种病原菌的抑菌率为100%;培养7 d时下降,其中Ta1和Th2抑菌效果最好,前者对胶孢炭疽菌、尖孢镰刀菌和新棒状拟盘多毛孢的抑菌率分别为74.1%、62.5%和75.0%,后者分别为74.1%、73.8%和75.9%。二者对草莓根腐病具有一定生防潜力。
关键词 草莓;根腐;分离;鉴定;木霉
中图分类号 S 436.5 文献标识码 A 文章编号 0517-6611(2022)09-0143-05
doi:10.3969/j.issn.0517-6611.2022.09.036
开放科学(资源服务)标识码(OSID):
Identification of Pathogens Causing Root Rot on Strawberry in Qingdao Laixi and Screening of Their Antibiotic Trichoderma spp.
WANG Ling-chao, MAO Hong-shuo, LIU Ye-bei et al
(College of Plant Health & Medicine of Qingdao Agricultural University / Key Lab of Integrated Crop Disease and Pest Management of Shandong Province, Qingdao, Shandong 266109)
Abstract Ninety samples were collected from 30 plots in 10 strawberry planting bases in Qingdao Laixi from 2018 to 2019,and isolated by tissue isolating method, combined with morphology, molecular biological technology and pathogenic test, the species causing root rot of strawberries were identified, meanwhile, antibiotic effects and mechanisms of 4 Trichoderma spp. to the pathogens were studied. The results indicated that 6 fungal species were isolated from rotten tissues of strawberries, including Colletotrichum gloeosporioides, Fusarium oxysporum, Neopestalotiopsis clavispora, Cladosporium cladosporioides, Acremonium sclerotigenum and Aspergillus terreus. Among them, the first three was the pathogens causing root rot of strawberries, the document frequency (DF) of C. gloeosporioides and F. oxysporum was 45.8% and 32.1%, respectively, while that of N. clavispora was 8.4%. Four Trichoderma spp. inhibited the above pathogens by competition and production of non-volatile compounds. After three days of inoculation, the inhibition percentage of the 4 Trichoderma spp. to the three pathogens were 100%, however, seven days after inoculation, the inhibition percentage decreased, the inhibition percentage of trichoderma Ta1 and Th2 were the highest, those of Ta1 to C. gloeosporioides, F. oxysporum and N. clavispora were 74.1%, 62.5% and 75.0%, respectively;those of Th1 were 74.1%, 73.8% and 75.9%, respectively. Therefore, Ta1 and Th2 had the best antibiotic effects and biocontrol potentials against root rot of strawberries.
Key words Fragaria×ananassa;Root rot;Isolation;Identification;Trichoderma spp.
近年来,我国草莓产业迅速发展,但随着栽培面积的扩大及多年连作,导致根腐病严重时发病率可达80%以上,给草莓生产带来了巨大的经济损失[1]。草莓根腐病症状表现为红中柱根腐[2-3]、炭疽根腐[4-7]和黑根腐[8-9],由土传病原真菌甚至线虫单独或复合侵染根部所致。世界范围内已报道的草莓根腐病菌达20多种[8],主要有草莓疫霉(Phytophthora fragariae)[2-3]、炭疽菌(Colletotrichum spp.)[4-7]、丝核菌(Rhizoctonia spp.)[10-11]、镰孢菌(Fusarium spp.)[12-13]、新棒状拟盘多毛孢(Neopestalotiopsis clavispora)[5,14-15]、菜豆壳球孢(Macrophomina phaseolina)[16-17]、大双孢土赤壳菌(Ilyonectria macrodidyma)[18]和Dactylonectria torresensis等[19-20]。
在农业生产中,由于化肥农药的大量使用导致的环境污染、生态失衡、农产品品质下降及农残超标等问题日益严重。木霉菌(Trichoderma spp.)是一类应用广泛、防病效果显著的生防菌[21]。较强的环境适应能力使其在与病原菌的竞争中占据优势,主要通过竞争、重寄生、抗生作用、诱导抗性及协同拮抗作用,使得木霉对大部分病原菌表现出较高的拮抗活性[22]。木霉菌对草莓炭疽病[23-25]、灰霉病[23,26]、白粉病[27]、根腐病等[28-29]具有拮抗作用。尽管前人在木霉防治草莓病害方面做了大量的工作,但目前仍缺少可替代化学农药防治草莓根腐病的高效木霉菌剂产品。
山东省青岛地区是我国草莓主栽区之一,目前已报道的草莓根腐病病原物种类有棒形拟盘多毛孢菌(Pestalotiopsis clavispora)和胶孢炭疽菌(Colletotrichum gloeosporioides)[5]。不同地区或同一地区,由于生态条件的差异,导致病原物优势种类差异较大。为了确定青岛莱西地区草莓根腐病菌的种类,笔者于2018—2019年共采集10个草莓种植地的90个病样,在对病原物分离、鉴定及测定致病性的同时,初步测试了4株木霉对草莓根腐病菌的拮抗活性及机理,这对于明确草莓根腐病菌的种类、推广木霉生物防治及减少化学农药的使用具有重要意义。
1 材料与方法
1.1 病样采集
2018—2019年2—4月,选取莱西地区草莓(章姬品种)10个种植地采样,每个种植地采集3个点,每个点取3株病样,带回实验室立即分离。
1.2 培养基制作
分离用马铃薯葡萄糖琼脂培养基(PDA)和燕麦(OA)琼脂培养基,纯化及保存培养基用PDA培养基。
1.3 试验方法
1.3.1 分离纯化及保存。
先将病株根部冲洗干净,沥干水分。在超净工作台上,用75%乙醇表面消毒后,再用消毒手术刀剖开根部,从病组织中切取0.5 cm2大小的组织块,转接到PDA培养基或OA培养基上,每皿放置3块,置于25 ℃黑暗培养。待组织块边缘长出菌丝体时,挑取菌丝体转接到PDA培养基上纯化,直至菌落生长一致没有杂菌时,挑取菌丝体转接至PDA斜面上,待长满斜面后于4 ℃冰箱保存。
1.3.2 形态学鉴定。
观察、记录分离物的菌落颜色、生长速度等。制作水装片,在光学显微镜下观察菌丝的颜色、隔膜、分生孢子、载孢体形态等特征,测量大小并拍照,依据《真菌鉴定手册》等资料鉴定[6-7,12-15,30-31]。
1.3.3 分子生物学技术鉴定。
采用CTAB法提取菌物的基因组DNA,利用引物ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)扩增DNA的内转录间隔区(ITS)序列[7]。扩增产物经琼脂糖凝胶电泳检测确认后,送测序公司纯化并测序。登陆BCBI网站与GenBank数据库中相似模式菌株序列进行比对,获得同源性较高的菌物,结合菌物的形态特征,参考相关文献确定分离物的分类地位。
1.3.4 分离频度测定。
为了确定分离物特别是病原菌的优势种类,用以下公式计算分离频度(document frequency,DF):
DF=(分离物某属或种的出现次数/分离总次数)×100%
1.3.5 致病性测定。
将分离物在PDA培养基上活化,待菌落上产生大量的分生孢子时,用无菌水冲洗孢子,3层无菌纱布过滤,滤液经5 000 r/min离心30 min后得到孢子沉淀,加无菌水稀释成1.0×105个/mL孢子的悬浮液备用。
待草莓苗生长至4~5叶期时,用手术刀在根部造成轻微伤口,采用灌根法接种[13-14],每株灌入25 mL孢子悬浮液。每种分离物重复3次,每重复1株苗。对照灌无菌水。接种后置于25 ℃光照培养箱培养(光照14 h/黑暗10 h)。期间浇水保持土壤湿润。观察草莓苗的变化,待出现明显症状时取样,用与上述相同的方法再次分离鉴定以完成柯赫氏法则验证。
1.3.6 木霉对病原菌的拮抗效果及拮抗机理测试。
供试的4种木霉编号为Th1、Ta1、Th2和Th3,其中Th1、Th2和Th3为哈茨木霉(Trichoderma harzianum),Ta1为深绿木霉(Trichoderma aureoviride),保存于青岛农业大学植物病理生理实验室。
1.3.6.1 竞争作用。