愈创木基丙三醇-β-愈创木基醚对土壤中多环芳烃的归趋的影响及微生物群落效应的研究
作者: 尹晗 季聪杰 安雪晖 孙月 陈禹竹
摘要 [目的]通过培养试验研究多环芳烃的归趋及降解过程的微生物共代谢机制。[方法]以木质素的一种单体模型愈创木基丙三醇-β-愈创木基醚(GGE)为基质底物、多环芳烃BaA为模式污染物,结合同位素示踪和选择性抑制等技术,设立微宇宙培养试验,采用定量PCR技术和扩增子测序等方法来分析GGE对BaA的归趋的影响及其微生物群落效应。[结果]在培养过程中,加入GGE作为底物基质,未能显著提升处理组的矿化率。定量PCR和高通量测序结果表明,GGE的加入改变了土壤微生物群落,且GGE对细菌群落的影响大于真菌群落。相比于对照,GGE处理组增加了细菌群落中α-变形菌纲、拟杆菌门的相对丰度,而β-变形菌纲和芽单胞菌门有所减少;增加了真菌群落中子囊菌门的相对丰度,而担子菌门的相对丰度有所减少。LEfSe分析表明,GGE的添加促进了Hyphomicrobiaceae、Rhodospirillaceae、Acidobacteriaceae、Burkholderiaceae等细菌科和子囊菌门等真菌的富集。[结论]GGE的添加在一定程度上提升了降解过程中真菌的贡献率。底物基质的添加可能会引起多环芳烃的不同微生物降解机制,促进真菌和细菌的协同作用。GGE的添加还富集了一些PAHs潜在降解菌,这些微生物的富集可能会在整体上提升芳香族化合物的代谢功能,增强土壤对多环芳烃类污染物的降解能力。
关键词 多环芳烃;愈创木基丙三醇-β-愈创木基醚;归趋;共代谢;微生物群落效应;同位素示踪技术
中图分类号 X 172 文献标识码 A 文章编号 0517-6611(2022)17-0056-06
doi:10.3969/j.issn.0517-6611.2022.17.014
开放科学(资源服务)标识码(OSID):
Study on the Effects of Guaiacylglycerol-β-guaiacyl Ether on the Fate of Polycyclic Aromatic Hydrocarbons and Microbial Community in Soils
YIN Han1,JI Cong-jie1,AN Xue-hui2 et al
(1.PowerChina Roadbridge Group Co.,Ltd.,Beijing 100048;2.School of Civil Engineering,Tsinghua University,Beijing 100084)
Abstract [Objective]The fate of PAHs and the mechanism of microbial cometabolism in degradation process were studied by microcosm experiment.[Method]Using GGE,a monomer model of lignin,as the matrix substrate and polycyclic aromatic hydrocarbon BaA as the model pollutant,combined with techniques such as isotope tracing and selective suppression,a microcosmic culture experiment was established,using quantitative PCR technology and expansion methods such as amplicon sequencing are used to analyze the influence of GGE on the fate of BaA and its microbial community effect.[Result]During the incubation,adding GGE as the substrate matrix failed to significantly increase the mineralization rate of the treatment group.The quantitative PCR and high-throughput sequencing results showed that the addition of GGE changed the soil microbial community,and GGE had a greater impact on the bacterial community than the fungal community.Compared with the control,the GGE treatment increased the relative abundance of Alpha-proteobacteria and Bacteroides in the bacterial community,while Beta-proteobacteria and Bacillus phylum decreased.The relative abundance of ascomycetes had increased in the fungal community,while the basidiomycetes decreased.LEfSe analysis showed that the addition of GGE promoted the enrichment of bacteria such as Hyphomicrobiaceae,Rhodospirillaceae,Acidobacteriaceae,Burkholderiaceae,and promoted fungi such as Ascomycota.[Conclusion]The addition of GGE increased the contribution rate of fungi in the degradation process to a certain extent.The addition of substrate matrix may cause different microbial degradation mechanisms of PAHs.It also could promote the synergy of fungi and bacteria.The addition of GGE also enriched some potential PAHs degradation microorganism.The enrichment of these bacterial genera may enhance the overall metabolism of aromatic compounds and enhance the ability of soil to degrade PAHs.
Key words PAHs;GGE;Fate;Cometabolism;Microbial community effect;Isotopic tracer technique
多环芳烃(PAHs)是含有2个或2个以上苯环连接在一起的烃类化合物,随着其环数增加、化学结构的变化和疏水性的增强,其化学稳定性、持久性、抗生物降解能力和毒性都会增强,多环芳烃已成为我国土壤中主要的有机污染物之一,被认定为影响人类健康的主要有机污染物[1]。一些高分子量有机物不能直接作为大部分微生物的唯一碳源和能源,在有其他化合物作为一级底物提供碳源和能源时,该有机物才能作为二级底物被降解,这种现象称为共代谢作用,这类一级底物被称为共代谢底物[2]。多环芳烃是一类难降解的有机污染物,分子量高,很少有微生物可以直接利用其作为唯一碳源,因此,高分子量多环芳烃通常以共代谢方式进行降解,共代谢过程已作为一种生物技术在芳香族化合物生物降解修复中得到广泛应用[3]。
木质素是一类复杂的有机聚合物,其化学结构与多环芳烃结构类似,已有研究表明,木质素具有刺激微生物降解芳香族污染物的作用[4]。木质素解聚产生大量双芳基或单芳基降解产物,它们的进一步代谢会诱导微生物产生胞外酶等物质,这些可能会促进多环芳烃降解。木质素促进芳香族污染物的降解过程,可能涉及共代谢机制,但其具体的微生物共代谢机制尚不明确。木质素在土壤中的降解过程涉及多种微生物,降解的不同阶段也具有不同的共代谢效应[5]。目前解决多环芳烃的污染问题以及深入地研究木质素促进多环芳烃降解的微生物共代谢机制对研究多环芳烃污染土壤的修复具有重要意义。因此,该研究选择了一种木质素模型二聚体化合物愈创木基丙三醇-β-愈创木基醚(guaiacylglycerol-β-guaiacyl ether,GGE)为刺激底物,以多环芳烃苯并[a]蒽(Benz(a)anthracene,BaA)为模式污染物,同时结合真菌抑制剂放线菌酮(cycloheximide),设立微宇宙培养试验,结合14C同位素示踪技术、定量PCR技术和扩增子测序来分析GGE对BaA的归趋的影响及其微生物群落效应。
1 材料与方法
1.1 土壤样品 土壤采集于南京市郊农田,自然风干,研磨后过2 mm网筛,保存于4 ℃,用于后续培养试验。土壤理化性质:pH 6.84、总碳12.7 g/kg、总氮1.3 g/kg、全磷0.57 g/kg、全钾19.3 g/kg、田间持水量33.3%。
1.2 主要化学试剂与仪器
[7,12-14C]苯并[a]蒽(14C-BaA,10 mCi/mmol,99%纯度),美国Radiolabeled Chemicals公司;苯并[a]蒽(12C-BaA,98%纯度),梯希爱(上海)化成工业发展有限公司;真菌抑制剂放线菌酮,西格玛奥德里奇(上海)贸易有限公司。液体闪烁分析仪(LSC),美国贝克曼库尔特有限公司;生物氧化燃烧仪(OX-500),德国Zinsser Analytic公司。
1.3 试验设计
设立2组微宇宙培养试验,2组处理相同,微宇宙培养试验在60 mL矿化管中进行,每管加入5.0 g土壤样品,土壤持水量为60%,处理组添加GGE的含量为500 μg/g,真菌抑制剂放线菌酮的含量为1 mg/g。
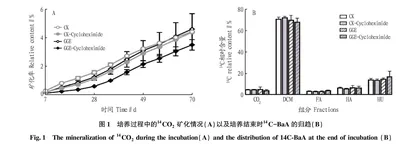
第一组通过同位素示踪技术,检测GGE处理组和对照组在有无放线菌酮存在的情况下14C-BaA的环境归趋,每个处理设3个平行。添加14C标记的BaA至土壤样品中[6],使其终浓度为50 μg/g,放射性为2.0×105 DPM。在矿化管内放置装有1 mL 1 mol/L NaOH溶液的小瓶子,收集释放的14CO 培养时间为70 d,每7 d取样测定培养过程中释放的14CO 2量,利用液体闪烁分析仪(LSC)测定NaOH溶液吸收的14CO 2含量[7]。
培养结束后,将矿化管内的土壤样品风干,过2 mm网筛,取2.0 g用二氯甲烷在50 ℃下索氏提取24 h,将萃取物旋蒸后用环己烷熔解,经LSC测定可提取态(DCM)含量。不可提取态(NER)进一步分离为富里酸(FA)、腐殖酸(HA)和胡敏素(HU)结合态。参照Shan等[8-9]的方法,将DCM提取后的土样风干,用0.1 mol/L无氧NaOH在250 r/min下振荡提取24 h,12 000 r/min离心30 min,所得沉淀为胡敏素,上清液为富里酸和腐殖酸的混合溶液,在上清液中加入6 mol/L HCl调节混合溶液pH至 4 ℃下沉淀24 h,7 000 r/min离心30 min,上清液为FA组分,利用LSC检测FA和HA组分的放射性,得到FA、HA结合态的含量。将胡敏素沉淀冷冻干燥后,用生物氧化燃烧仪在900 ℃下完全氧化4 min,收集氧化后产生的14C标记的CO 并用LSC检测HU组分放射性,得到HU结合态的含量。
第二组添加未标记的12C-BaA至土壤样品中,使其终浓度为50 μg/g,用于检测培养过程中的微生物变化,每个处理6个重复,分别在培养中期(第42天)和培养结束(第70天)时,各取3支破坏性取样。土壤样品置于-20 ℃保存,用于后续微生物分析。使用FastDNA SPIN Kit for Soils土壤DNA提取试剂盒,参照试剂盒说明书操作,提取土壤样品中的DNA。测定DNA浓度后,置于-20 ℃保存。
采用定量PCR的方法,测定各样品中细菌16S rRNA基因、18S rRNA基因、甲醇脱氢酶 mxaF/xoxF 基因和革兰氏阳性菌多环芳烃双加氧酶GP PAH-RHDα 基因表达丰度。土壤样品总DNA稀释至10-1浓度,作为定量模板,定量PCR反应体系 (20 μL):Top Green qPCR SuperMix (SYBR Green) 10.0 μL,正、反向引物 (10 μmol/L)各0.4 μL,ddH 2O 7.2 μL,模板DNA 2.0 μL。采用细菌16S rRNA基因序列PCR通用引物Eub338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和Eub518R (5′-ATTACCGCGGCTGCTGG-3′),扩增目的片段[10];定量PCR扩增程序:95 ℃ 3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃ 10 min。采用真菌18S rRNA基因序列PCR通用引物nu-SSU-0817 (5′-TTAGCATGGAATAATRRAATAGGA-3′)和nu-SSU-1536 (5′-ATTGCAATGCYCTATCCCCA-3′),扩增目的片段[11];定量PCR扩增程序:94 ℃ 3 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃ 10 min。采用 mxaF/xoxF 基因序列PCR通用引物mdh1 (5′-GCGGIWSCAICTGGGGYT -3′)、 mdh2 (5′-GCGGIWSGAICTGGGGYT -3′)和mdhR (5′-GAASGGYTCSYARTCCATGCA -3′),扩增目的片段[12];定量PCR扩增程序:95 ℃ 5 min;95 ℃ 1 min,53 ℃ 1 min,72 ℃ 1 min,40 个循环;72 ℃ 10 min。采用GP PAH-RHDα基因序列PCR通用引物GP RHDα F (5′-CGGCGCCGACAAYTTYGTNGG -3′)和GP RHDα R (5′-GGGGAACACGGTGCCRTGDATRAA-3′),扩增目的片段[13];定量PCR扩增程序:95 ℃ 3 min;95 ℃ 20 s,54 ℃ 30 s,72 ℃ 30 s,40 个循环;72 ℃ 10 min。