3株芽孢杆菌的分离鉴定及其促生效果研究
作者: 郭真 陈倩倩 陆星 田江 彭桂香 梁翠月
摘要 [目的]获得安全高效的微生物肥料备用菌种。[方法]分别从贵州石漠化土壤和广东水稻土中分离得到3株芽孢杆菌,对其进行16S rRNA序列分析鉴定种属,分析其形态学和其他生理生化特性,采用大豆盆栽试验进行促生功能研究。[结果] 16S rRNA基因序列分析结果显示,菌株RL1和Y26与沙佛芽孢杆菌(Bacillus safensis)、P90与阿氏芽孢杆菌(Bacillus aryabhattai)的系统发育相似性最高。生理生化特征显示,3株芽孢杆菌均具有不同程度地解磷、泌氢以及产吲哚-3-乙酸的能力。其中,RL1的解磷能力和泌氢能力均显著高于其他2个菌株。在盆栽试验中接种这3株菌株均提高了大豆植株的生物量和磷含量。在正常磷条件下,促生效果RL1>P90>Y26。其中,与不接种处理相比,RL1处理条件下大豆地上部干重、根系干重、地上部磷含量和根系磷含量分别增加了68.32%、40.38%、48.29%和57.33%。钙磷处理条件下,促生效果P90>Y26>RL1。其中,与不接种处理相比,接种菌株P90条件下,大豆植株的地上部干重、根系干重、地上部磷含量和根系磷含量分别提高了64.2%、48.21%、39.77%和73.62%。[结论]该研究所分离的3株菌株在促进作物生长方面均具有一定的应用潜力,可为微生物肥料的研制提供优质的菌种资源。
关键词 芽孢杆菌;解磷;吲哚-3-乙酸;促生;大豆
中图分类号 S 154.3 文献标识码 A 文章编号 0517-6611(2022)18-0126-06
doi:10.3969/j.issn.0517-6611.2022.18.032
开放科学(资源服务)标识码(OSID):
Isolation, Identification and Growth Promoting Effect of Three Bacillus Strains
GUO Zhen, CHEN Qian-qian, LU Xing et al
(Root Biology Center/College of Natural Resources and Environment, South China Agricultural University, Guangzhou,Guangdong 510642)
Abstract [Objective] To obtain safe and efficient microbes for microbial fertilizers production.[Method]Three Bacillus strains, which isolated from rocky desert soil in Guizhou and paddy soil in Guangdong, were characterized at morphological, physiological, biochemical and molecular biological level. Their growth-promotion effects were investigated. [Result]The 16S rRNA sequence analysis showed that RL1 and Y26 belonged to Bacillus safensis, while P90 belonged to Bacillus aryabhattai. All the three Bacillus strains were able to remobilize sparingly soluble phosphorus, secrete H+, and produce indole-3-acetic acid. Among them, RL1 had the strongest capacity for phosphate remobilization and H+ secretion. The pot experiment showed that inoculation of all the three strains could increase the biomass and phosphorus content of soybean plants. Moreover, the growth-promotion effect of RL1 on soybeans was the strongest under normal phosphorus condition. Compared to the non-inoculation control, inoculation of RL1 increased the soybean shoot dry weight, root dry weight, shoot phosphorus content and root phosphorus content by 68.32%, 40.38%, 48.29% and 57.33%, respectively. However, under tricalcium phosphorus condition, the growth-promotion effect of P90 was the strongest. Compared to the non-inoculation control, inoculation of P90 increased the shoot dry weight, root dry weight, shoot phosphorus content and root phosphorus content by 64.2%,48.21%,39.77% and 73.62%, respectively.[Conclusion]The three strains all had application potential in plant growth promotion and they could provide high-quality microbes resources for the development of microbial fertilizers.
Key words Bacillus;Phosphate solubilization;Indole-3-acetic acid;Promoting growth;Soybean
随着人口的增加,人们对农产品安全及产量的需求也逐渐加大。化肥作为农业生产的基础,在促进粮食增产方面起着至关重要的作用,但近几十年来肥料的过量施用已导致我国农业投入产出比明显降低,甚至造成农业生态环境的严重污染[1]。为了维持农业的可持续发展,人们对新型农用肥料的需求呈上升趋势。而微生物在土壤改良和农作物增产等方面的重要作用已逐渐为人们所认识。目前,利用促生菌、根瘤菌、菌根真菌等有益微生物作为主体的新兴微生物肥料,已在农业生产上得到广泛应用,在推动我国绿色农业方面发挥不可估量的作用[2]。
其中,促生菌(plant growth-promoting bacteria,PGPB)是一类通过复杂的直接或间接机制促进植物生长发育、防治病虫害的一类微生物[3],促生菌在农业生产上能够活化土壤养分,帮助作物抵御疾病,促进作物的生长繁殖,其作用机理主要包括调节植物激素(如产ACC脱氨酶、分泌吲哚乙酸、赤
霉素等),活化土壤养分(溶磷、解钾以及固氮),调控次生代谢物的释放以及病原体的防治等[4-6]。目前发现芽孢杆菌、青霉菌、假单孢菌及根瘤菌属等均有促进植物生长的作用[7-9]。其中芽孢杆菌在农业生产上是利用较多的一类促生菌[10]。Azaroual等[11]研究发现,在小麦根际接种2种不同的芽孢杆菌,均能有效溶解土壤中的难溶性磷,提高了小麦对磷的利用,从而促进其生长发育。刘鲁峰等[12]发现在根际接种内生枯草芽孢杆菌后,甘蔗的根系长度、活力和生物量等指标均显著高于不接种对照 。这些研究表明,某些芽孢杆菌能够显著促进植物生长,且其对植物的促生作用机理不同。因此,解析芽孢杆菌促进植物生长的机理对于充分利用芽孢杆菌资源具有重要指导意义。
20世纪80年代以来,我国微生物肥料产业发展迅速,规模逐渐增加,工业化及生产水平不断提高,推广应用范围也在逐步扩大[13],但也存在如微生物资源保存数量不足、机理研究工作不充分、有益微生物开发利用率低等问题[14-15]。因此,笔者从不同土壤筛选出3株芽孢杆菌,研究这3株菌株的促生和解磷功能,为农用微生物肥料的开发提供重要的菌种资源。
1 材料与方法
1.1 供试菌株的分离
从广东省湛江市(32°98′48.46″E、114°35′44.05″N)水稻土中分离了一株芽孢杆菌,将其命名为RL1;从贵州省兴义市(104°54′13.02″ E、24°58′17.44″ N)[16]大豆根际土壤中分离了2株芽孢杆菌,分别命名为Y26和P90。
1.2 菌株的形态特征鉴定
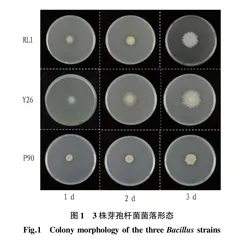
挑取单克隆于装有液体LB培养基的2 mL离心管中,在摇床中28 ℃ 180 r/min培养至对数生长期,吸取2 L菌液于LB固体培养基,培养箱中28 ℃下培养,并分别在24、48、72 h对其拍照。
将目标菌株活化后,挑取单克隆,用无菌水将其稀释成菌悬液备用。吸取10 L菌悬液滴将其固定在洁净的载玻片中央,在干燥后的菌膜上滴加结晶紫染色液,染色1 min后,用无菌水清洗多余的染色液;然后滴加碘液染色1 min,再用清水清洗多余染色液;加95%乙醇,摇动玻片脱色20~60 s,吸去多余水分,滴加番红染液复染1 min,用水清洗,吸去多余水分,用油镜观察菌体颜色及形态。
1.3 菌株16S rRNA 分子鉴定
微生物DNA的提取按照细菌DNA提取试剂盒所示方法提取(Omega D3350 Bacterial DNA Kit)。以上述步骤提取的DNA为模板,用PCR反应引物进行扩增。上游引物序列:5′-GTTTGATCMTGGCTCAG-3′;下游引物序列:5′-TACGGYTACCTT GTT ACGACTT -3′。PCR反应条件:94 ℃保持3 min;94 ℃ 0.5 min,54 ℃ 0.5 min,72 ℃ 2 min,35个循环;72 ℃保持7 min。
取5 μL PCR产物到 1%琼脂糖凝胶上电泳约20 min,将清晰条带送至天一辉远生物科技有限公司(广州)测序,所得序列在NCBI blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)和LPSN基因库(https://bacterio.net/)数据库中进行核苷酸序列比对,获得其同源性较高的序列,然后用MEGA 5.2软件对这些序列进行分析,并构建系统发育树。
1.4 微生物解磷能力测定
对菌株的解磷能力进行了定性和定量测定。定性试验:活化目标菌株后,挑取单克隆于1 mL液体LB培养基,在摇床中28 ℃、180 r/min培养至对数生长期,用移液枪吸取2 μL不同浓度(1、10-1、10-10和10-100)菌液于无机磷固体培养基,在28 ℃培养21 d后拍照观察溶磷圈。定量试验:吸取1%的菌液在50 mL无机磷培养基中,28 ℃、180 r/min培养21 d,每3 d吸取2 mL含菌液的液体培养基,5 000 r/min离心3 min,取上清液用钼蓝比色法测定可溶性磷含量。对照试验CK为不加菌液的处理,每个处理设4个重复。
1.5 微生物泌氢能力测定
对菌株的产酸能力进行了定性和定量测定。在定性试验中,取单克隆接种于1 mL 液体LB培养基中,28 ℃、180 r/min培养至对数生长期,将其稀释4个倍数(1、10-1、10-10、10-100),并吸取2 μL不同浓度的菌液于固体PVK改良培养基表面,在28 ℃中培养4、5和6 d后拍照。定量试验中,取单克隆接种于1 mL液体LB培养基,28 ℃、180 r/min培养至对数生长期,吸取1%的菌液接种于50 mL无机磷培养基,28 ℃、180 r/min培养15 d,每3 d吸取2 mL的上清液,测定pH。对照试验CK为不加菌液的处理,每个处理4个重复。