一种免疫调节肽的小鼠经口急性毒性试验
作者: 焉扬 鲁令华 刘晓东 杜恒裔 邵坤 王述柏
摘要 试验采用急性毒性试验的限量法,将54只小鼠随机分为3组,Ⅰ、Ⅱ组为试验组,Ⅲ组为对照组。试验组Ⅰ、Ⅱ分别灌胃剂量200和400 mg/kg的免疫调节肽,对照组灌胃等量蒸馏水。结果表明,各试验组小鼠眼部、鼻孔、皮肤等器官均未出现临床中毒症状,经解剖观察发现各内脏器官生长发育正常,均无大体解剖病理变化,各试验组公鼠的生长性能以及小鼠血常规指标、血清生化指标和脏器系数与对照组相比均无显著差异(P>0.05);2个试验组母鼠末重、平均日增重显著高于对照组(P<0.05),各组小鼠始重、平均日采食量和料重比差异均不显著(P>0.05)。由此可见,该试验所用免疫调节肽对小鼠无急性毒性作用。
关键词 免疫调节肽;小鼠;急性毒性试验
中图分类号 S 859.79+7文献标识码 A
文章编号 0517-6611(2022)22-0066-07
doi: 10.3969/j.issn.0517-6611.2022.22.017
开放科学(资源服务)标识码(OSID):
Acute Oral Toxicity Test of an Immunomodulatory Peptide in Mice
YAN Yang,LU Ling-hua,LIU Xiao-dong et al
(College of Veterinary Medicine,Qingdao Agricultural University,Qingdao,Shandong 266109)
Abstract The limit method of the acute toxicity test was used in the experiment. 54 mice were randomly divided into 3 groups,test group Ⅰ,test group Ⅱ,control group. The mice in test group Ⅰ and test group Ⅱ were administrated with 200 and 400 mg/kg immunomodulatory peptide,the mice in the control group were administrated with the same dose of distilled water. The results showed that the eyes,nostrils,skin and other organs of the mice in each test group had no clinical symptoms of poisoning. The growth and development of various internal organs were observed by anatomy,and there were no general anatomical and pathological changes. The growth performance of the male mice and hematology routine indices,serum biochemical indices,and organ coefficients of mice in the test groups had no significant difference with those in the control group(P>0.05). The final body weight and average daily weight gain of the female mice in the two test groups were significantly higher than those in the control group(P<0.05). The initial body weight,average daily feed intake and feed-to-weight ratio had no significant difference between the groups(P>0.05). Therefore,the immunomodulatory peptide used in this experiment had no acute toxic effect on mice.
Key words Immunoregulatory peptide;Mice;Acute toxicity test
生物活性肽是对机体的生命活动有一定生理作用的肽类化合物,相对分子质量小于6 000 D[1-2],其分子结构复杂程度不一[3],是一类介于氨基酸和蛋白质之间的多肽[4]。1902年,英国科学家Bayliss等[5]首次发现了生物活性肽,自此国内外学者对活性肽开展了大量研究[6]。活性肽根据生理功能可分为免疫调节肽、抗菌肽、血压调节肽、神经活性肽、呈味肽等[7-8],其中免疫调节肽因其独特的免疫增强作用备受研究者关注[9-10]。Xu等[11]从中华小公鱼胃蛋白酶产物中筛选出具有免疫调节活性的五肽YVMRF,研究发现这种肽能促进小鼠RAW264.7细胞系分化,增加一氧化氮(NO)、白细胞介素-6、白细胞介素-1和肿瘤坏死因子-α的产量。叶盛旺等[12]从青蛤胃蛋白酶产物中筛选出的活性肽免疫调节活性高,能显著增强小鼠巨噬细胞系RAW264.7的吞噬能力、NO的分泌水平和细胞因子的分泌量。Li等[13]利用木瓜蛋白酶和胰蛋白酶酶解阿拉斯加鳕鱼蛋白得到多肽ACNGR,发现这种肽能提高环磷酰胺诱导小鼠的免疫器官指数,促进脾淋巴细胞的增殖,增加与肠黏膜免疫相关的SIgA、IgA、IL-6、IL-10的分泌,从而增强小鼠肠道黏膜的免疫功能,可见免疫调节肽有望成为动物抗生素类饲用添加剂的替代物。但是,对新型饲用添加剂开展毒理学评价是其推广应用前必不可少的。符大勇等[14]研究了海洋生物表面活性肽(SPR)的急性毒性,试验期间小鼠无任何中毒症状、无死亡,经大体病理学观察发现脏器无异常变化,因此确定SPR对小鼠无毒性。刘泳廷等[15]利用小鼠的急性毒性试验研究野生盔孢伞中鹅膏毒肽的毒性,结果显示小鼠出现不同程度的中毒症状,随鹅膏毒肽剂量的增加肝细胞肿胀、坏死,伴有出血和炎细胞浸润的病变逐渐加重,确定小鼠半数致死量(LD 50)为108 mg/kg。笔者以小鼠为实验动物,研究了一种新合成免疫调节肽的急性毒性,旨在为其安全性评价和推广应用提供参考依据。
1 材料与方法
1.1 试验材料 免疫调节肽:白色粉末,纯度不低于98.5%,由青岛农业大学预防兽医学研究室制备。小鼠配合饲料及垫料,购自济南朋悦实验动物繁育有限公司。
1.2 实验动物 54只体重相近(24~26 g)的清洁级ICR系小鼠,购自济南朋悦实验动物繁育有限公司。
1.3 试验时间和地点 试验于2017年5月在青岛农业大学实验动物房和预防兽医学研究室进行。
1.4 试验方法 采用急性毒性试验的限量法[16]进行试验设计, 将54只小鼠饲养于实验动物房内观察、适应5 d,在此期间自由采食饮水;确认健康无病后,将小鼠随机分为3组(Ⅰ、Ⅱ组为试验组,Ⅲ组为对照组),每组18只(雌雄各半),公母分笼饲养。所有小鼠饲养条件、饮用水、饲料保持一致。实验动物房内室温20~25 ℃,湿度50%~70%,通风良好,并保持卫生清洁。
通过预试期试验获得小鼠适宜灌胃量为0.2 mL/只,根据实测体重计算每只小鼠免疫调节肽的使用量,准确称取待检样品并将其溶于蒸馏水中。试验组Ⅰ和Ⅱ分别灌胃剂量200和400 mg/kg 的免疫调节肽溶液0.2 mL,对照组灌胃等量蒸馏水。灌喂前禁食6 h,只供应饮水,给予受试物后继续禁食2 h。
1.4.1 临床观察。
试验期间,每天观察小鼠皮肤、被毛、眼、黏膜组织以及呼吸系统、泌尿生殖系统、消化系统和神经系统等组织器官有无异常变化,记录动物发生异常变化的时间、程度以及持续时间,评估可能发生毒性作用的靶器官或组织,精确记录死亡时间和死亡时体重。观察试验期间各组织器官的异常变化,判定依据参见文献[17]。连续观察14 d。
1.4.2 生长性能测定。于试验开始当日和试验期末,准确称量试验小鼠体重,每日准确记录加料重、剩料重,计算每日采食量。最后,计算试验期间平均日增重、平均日采食量和料重比。
1.4.3 病理学检查。所有小鼠(包括试验过程中死亡小鼠、试验结束时处死小鼠)均进行大体解剖,观察并记录小鼠的肝脏、脾脏、肾脏、心脏、胃、肠、睾丸或卵巢的病理学变化;大体解剖病理改变时,进一步进行病理组织学观察;准确称量各器官重量,计算脏器系数:脏器系数=脏器重量/体重。
1.4.4 血液生理学指标检测。
1.4.4.1 血样采集。于试验期结束日(第14天),采用摘眼球采血法采集血样,一部分用于检测血常规指标,另一部分离心分离血清,用于检测血清生化指标。
1.4.4.2 血常规指标检测。使用全自动流式血细胞计数仪检测,检测指标包括白细胞总数、淋巴细胞比率、中性粒细胞比率、淋巴细胞数目、中性粒细胞数目、红细胞总数、血红蛋白含量、红细胞压积、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度、红细胞分布宽度变异系数、红细胞分布宽度标准差、血小板总数、平均血小板体积、血小板分布宽度和血小板压积。
1.4.4.3 血清生化指标检测。采用全自动生化分析仪和试剂盒检测,检测指标包括血清丙氨酸氨基转移酶活性、天冬氨酸氨基转移酶活性、碱性磷酸酶活性、谷氨酰基转移酶活性以及总蛋白、白蛋白、球蛋白、甘油三酯、胆固醇、尿素、肌酐和葡萄糖含量。试验所用试剂盒均购自北京安普生化科技有限公司。
1.5 数据处理
试验数据采用Excel软件初步整理后,使用SPSS 17.0统计软件的单因素方差分析和Duncan法进行组间差异显著性比较。试验结果均以“平均值±标准差”表示。结果分析参考文献[18]的方法。
2 结果与分析
2.1 临床观察结果
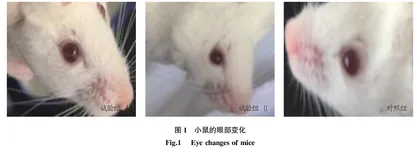
试验期间各试验组和对照组小鼠的眼部(图1)、鼻孔(图2)、母鼠的乳房(图3)、母鼠的阴部(图4)、公鼠的阴部(图5)以及小鼠的被毛(图6)均未出现异常变化,呈健康状态。
2.2 大体解剖病理学检查结果
解剖观察各组小鼠的内脏器官(包括胃、肠、肝、脾、肾、心脏、睾丸、卵巢),发现均无临床病理学变化(公鼠见图7,母鼠见图8),呈健康状态。
2.3 免疫调节肽对小鼠生长性能的影响
由表1可知,试验组Ⅱ公鼠末重和平均日增重略高于对照组和试验组 Ⅰ(P>0.05),料重比分别较对照组和试验组 Ⅰ低0.77和0.40,但各组公鼠始重和末重无显著差异(P>0.05),试验期间各组公鼠的平均日采食量和料重比亦无显著差异(P>0.05)。由表2可知,各组母鼠始重无显著差异(P>0.05);试验组Ⅰ、Ⅱ的母鼠末重、平均日增重均显著高于对照组(P<0.05),各组平均日采食量和料重比均无显著差异(P>0.05)。观察期间,各组公鼠和母鼠均无死亡。
2.4 免疫调节肽对小鼠血常规指标的影响
由表3可知,各组小鼠的白细胞总数、淋巴细胞比率、中性粒细胞比率、淋巴细胞数目、中性粒细胞数目、红细胞总数、血红蛋白含量、红细胞压积、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度、红细胞分布宽度变异系数、红细胞分布宽度标准差、血小板总数、平均血小板体积、血小板分布宽度和血小板压积均无显著差异(P>0.05)。
2.5 免疫调节肽对小鼠血清生化指标的影响
由表4可知,各组血清丙氨酸氨基转移酶活性、天冬氨酸氨基转移酶活性、碱性磷酸酶活性和谷氨酰基转移酶活性无显著差异(P>0.05),各组血清总蛋白、白蛋白、球蛋白、甘油三酯、胆固醇、尿素、肌酐和葡萄糖含量均无显著差异(P>0.05)。
2.6 免疫调节肽对小鼠脏器系数的影
由表5可知,各组公鼠、母鼠的脏器系数(包括肝、脾、肾、心脏、胃、肠)均差异不显著(P>0.05),各组母鼠的卵巢系数及公鼠的睾丸系数亦无显著差异(P>0.05)。