关于“利用化学方程式的简单计算”的几点认识
作者: 桑付刚
摘 要: 利用化学方程式的简单计算,是初中化学学习过程中的重点和难点。很多学生掌握课本介绍的步骤和方法后,练习过程仍然经常出错,感觉利用化学方程式易学难用,逐渐对此类题目产生畏惧感。文章从基本化学知识的准备、解题思路、化学方程式的书写、格式规范、计算能力、图像图表阅读等多个角度阐述了学生学习过程中易忽视的几个方面,帮助学生正确认识有关化学方程式的简单计算,提高学生学习兴趣。
关键词: 化学方程式;简单计算;教学
中图分类号: G633.8 文献标识码: A 文章编号: 1673-8918(2022)08-0135-04
利用化学方程式的简单计算在《义务教育化学课程标准(2011年版)》中的要求并不高:①能根据化学反应方程式进行简单的计算;②认识定量研究对化学科学发展的重大作用。但它是学习化学、应用化学的一个重要组成部分,也是学生学习、研究化学反应的基本技能。它不仅能让学生从定量的观点加深对化学反应的理解认识,促进学生形成完善的化学知识体系,而且能培养学生分析解决问题能力以及思维能力、计算能力。在中考试题中,利用化学方程式的简单计算经常是区分度最大的题目,因此,在初中化学教学过程中,利用化学方程式的简单计算一直占有突出的地位。
在实际教学过程中,教师一般都采取面向全体、结合学情、放慢速度、减小台阶、小步慢走、以练为主的教学设计,因此课堂教学都能比较顺利地完成,但练习时,很多学生还是反映本课题学习困难,逐渐对利用化学方程式的简单计算产生回避、畏难情绪,最后出现明显的学习分化现象,这也成为初中化学学习过程中最大的一个分化点。文章从基本化学知识的准备、解题思路、化学方程式的书写、格式规范、计算能力、图像图表阅读等方面,多角度分析学生学习过程中产生感觉困难的原因,试图寻找突破掌握利用化学方程式简单计算的方法。
一、 学习利用化学方程式的简单计算前的相关化学知识准备
利用化学方程式的简单计算的学习过程,既是培养学生计算能力的过程,也是培养学生对化学基本概念和理论、元素化合物知识、实验基本操作技能等知识的综合应用过程,因此,计算既是方法,也是综合知识掌握结果的体现,相关化学知识掌握不牢,是学习利用化学方程式的简单计算出现困难的最大原因。
【例1】 测定鸡蛋壳的主要成分碳酸钙的质量分数。实验如下:将鸡蛋壳洗净、干燥并捣碎后,称取8.0 g放在烧杯里,然后往烧杯中加入足量的稀盐酸55 g,充分反应后,称得反应剩余物为 59.92 g (假设其他物质不与盐酸反应)。请回答:
(1)产生二氧化碳气体的质量为 g。
(2)计算该鸡蛋壳中碳酸钙的质量分数。
【分析】 解答(1)时,学生通过阅读题目都能写出该题化学方程式:
CaCO 3+2HCl CaCl 2+H 2O+CO 2↑
学生们也都知道“反应剩余物”为生成的CaCl 2、H 2O以及不参加反应的“其他物质”形成的混合物,因此不会把题目中“55 g”这一数据代入化学方程式展开计算,但容易忽视“盐酸”是氯化氢气体的水溶液,也是混合物这一基础知识,把试题中“稀盐酸55 g”误认为化学方程式中“HCl”的质量,将这一数据代入化学方程式,展开计算,求解产生的二氧化碳质量,造成出错。该问题的实质是考查质量守恒定律的理解、应用,放入的物质总质量为鸡蛋壳与稀盐酸质量和,这与书写的化学方程式反应物为CaCO 3和HCl对应,所以,反应前物质总质量为:
8.0 g+55 g=63.0 g
二氧化碳通常为气体状态,反应生成后从烧杯中逸出,所以,减少的质量即为生成的二氧化碳质量:
63.0 g-59.92 g=3.08 g。
题目中提到的反应容器“烧杯”也不能忽视,若学生忘记烧杯是较大量试剂的反应容器这一基本用途,产生的气体易从烧杯口逸出这一实情,也不容易联想到用质量守恒定律解答问题(1)。所以,利用化学方程式的简单计算,“计”在前,考虑相关化学基础知识应用为先,“算”在后。
【例2】 某钢铁厂每天需消耗5000 t含Fe 2O 3 76 % 的赤铁矿石,该厂理论上可日产含Fe 98 % 的生铁的质量是多少?(利用化学方程式计算)
【分析】 部分学生写完“解:设日产生铁的质量为x”后,开始茫然无措,不知道物质发生什么化学反应得到生成物,不能写出化学方程式,不知往下如何解答。实际该练习涉及的基本反应原理为:
在高温下,一氧化碳夺取氧化铁里的氧,将铁还原出来,化学方程式为:
Fe 2O 3+3CO 高温 2Fe+3CO 2
若不掌握炼铁基本原理,写不出原理化学方程式,利用化学方程式计算步骤、方法掌握再熟练,也无用武之地。
二、 正确书写化学方程式
化学方程式是对化学反应最简洁、全面的描述。它是建立在对化学反应相关知识的高度认识掌握基础上的结果,不是简单的文字转换字母的游戏。它不仅表示化学反应的反应物、生成物及反应条件(即化学反应“质”的关系),还能表示反应物、生成物各物质之间的质量比,表示反应物、生成物各种粒子的相对数量关系(即化学反应“量”的关系),其中,化学方程式表示的反应物、生成物之间的质量比是化学方程式计算最直接的依据。正确书写化学方程式是利用化学方程式简单计算的根本前提之一,这就要求学生不仅相关化学反应知识要全面掌握,而且对元素符号、化学式等化学用语更得有充分的认识、理解、应用能力。
学生实际练习过程中,常出现的化学方程式书写错误有以下几种:①漏落或添加反应物、生成物;②错写反应物、生成物化学式;③不写、漏写反应条件;④忘记或错标生成物状态;⑤化学方程式未配平。这些错误的出现,有时并不影响计算数值结果,因此具有更大的欺骗性,学生往往在完成解答后,发现除了“设”正确,其余一错到底,不由感觉利用化学方程式计算太复杂、太难,产生畏难情绪。
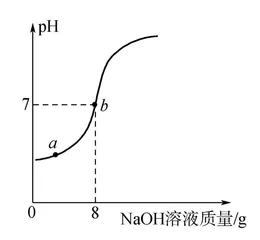
【例3】 欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30 g稀硫酸样品于烧杯中,将15 % 的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示:
回答下列问题:
(1)a点溶液中的溶质是 ;(填化学式)
(2)该稀硫酸溶质质量分数。(写出计算过程,结果精确到0.1 % )
【分析】 问题(2)解答,学生阅读图像可获得,稀硫酸与氢氧化钠溶液恰好完全反应时溶液pH=7,此时消耗的氢氧化钠质量为:
8 g×15 % =1.2 g,
写完正确的“解:设硫酸质量为x”后,化学方程式写作:
H 2SO 4+2NaOH Na 2SO 4+H 2O
在不犯其他错误情况下,一气呵成,数值结果与答案也相同,教师批改错误后,学生往往认为自己粗心大意,犯的是小错,只要结果正确就行,其他如:利用氯酸钾分解制取氧气反应计算时,书写的化学方程式中催化剂、加热等反应条件漏写,氧气气体符号漏标,把碳酸钠化学式错写为NaCO 3等错误时时出现,学生不认真改正基础知识错误,只一味计算数值,造成类似错误不断重复,进而对利用化学方程式的简单计算产生畏难情绪。
三、 建立正确的解题思路
陶行知先生说过“我们特别注意自动力之培养,使它关注于全部的生活学习工作之中”,这一思想同样适用于化学方程式计算的学习。利用化学方程式的简单计算课题学习时,多数教师把教学重点放在完整步骤总结上:
(1)设未知量;
(2)写出反应的化学方程式;
(3)写出相关物质的化学计量数与相对分子质量的乘积以及已知量、未知量;
(4)列出比例式,求解;
(5)简明地写出答案。
学生学习过程感觉清晰明了,很容易理解并掌握例题步骤内容、要求,但实际练习时,只要练习题比例题有较大改变,学生经常出现仅能完成第一步解、设、表达,往下开始茫然无措情况。出现这种情况的原因是学生并没有建立正确的利用化学方程式进行简单的计算思路,把教材解答时规范的书写步骤当作解题思路机械套用。更有学生读题时,根本不找题目中的化学反应,把利用化学方程式的简单计算所依据的化学反应扔在一边,先查找已知量值,然后看题目最后求解内容,机械写出未知量为x。
【例4】 锌与稀盐酸(HCl)反应生成氢气和氯化锌,实验室用6.5 g锌与足量稀盐酸反应,可制得氢气和氯化锌的质量各是多少?
【分析】 不少同学匆忙读完题目,顺利写出“解:设制得的氢气质量为x,氯化锌质量为y”,然后,就再也做不下去了。究其原因,学生并没有建立正确的解题思路。
正确的利用化学方程式的简单计算思路一般为:
(1)认真读题,弄清楚题目中涉及的化学反应原理。
该练习中“锌与盐酸(HCl)反应生成氢气和氯化锌”,即是告知学生题目计算依据的化学反应原理。
(2)正确书写化学方程式
Zn+2HCl ZnCl 2+H 2↑
由此可见,认真读题,是要求学生通过读题先找出题目中相关的化学反应原理,并写出正确的化学方程式,而不简单机械套用课本例题书写格式,把书写格式当作解题思路。化学方程式及其含义这一学习对化学方程式计算的学习有着促进作用。如果缺乏这一学习环节,化学方程式计算的学习就只能停留在对一般问题的解决上,不能达到化学问题解决的更高层次的学习。
四、 扎实的数学计算能力
利用化学方程式的简单计算,应用的数学知识并不难,基本为小学数学四则运算和比例式计算。进行基本数学计算知识测试,在四则运算知识方面学生间没有明显的差距,但在解答比例式的计算过程中,学生间表现出明显差别,表现在利用化学方程式简单计算时,解答步骤在比例式列出时,所用时间基本相等,正确率几乎一样,到求解比例式时,一些同学需要花费更多时间进行运算,结果还往往出现错误,基本是计算能力差的同学对比例式意义、计算时数据间的约分等计算技巧应用方面差距大造成的。
【例5】 实验室制得的纯碱样品中通常含有少量的氯化钠,现有含氯化钠杂质的纯碱样品 22.8 g, 溶于308.6 g水中完全溶解,向该溶液中加入208 g的氯化钡溶液,恰好完全反应,生成沉淀质量为39.4 g。
求:(1)原样品中的碳酸钠的质量;(2)反应后所得溶液的溶质质量分数。
【分析】 以(1)解答为例,前面几步解答,学生间没有差距:
解:设原样品中碳酸钠质量为x:
Na 2CO 3+BaCl 2 BaCO 3↓+2NaCl
106 197
x 39.4 g
106 197 = x 39.4 g
解答比例式求解:
x= 106×39.4 g 197