构建思维模型 提升思维品质
作者: 林立豪
[摘 要]沉淀溶解平衡图像体现了数形结合的思想,表征了微粒间的数量关系。在“沉淀溶解平衡图像”习题课中创设问题情境,引导学生重温沉淀溶解平衡知识,学会获取图像信息,并进行信息整合和推理分析,向学生渗透建模思想。通过沉淀溶解平衡图像模型的建构及迁移应用,强化学生模型思维的形成,发展学生思维的灵活性和敏捷性,促使学生实现“知识→认知→能力”的提升。
[关键词]模型建构;沉淀溶解平衡;思维模型
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2024)17-0058-04
鲁科版高中化学选择性必修1《化学反应原理》模块的教学主要是引导学生认识自然界和生产、生活中存在的各种各样奇妙的化学反应,有效提升学生对化学反应的认识,并通过探索纷繁复杂的化学反应背后的本质和规律,掌握有关化学反应的基本原理和研究方法。“物质在水溶液中的行为”章节主要涉及酸、碱、盐等电解质在水溶液中的变化,学习这些变化有助于学生形成基于微观、动态、平衡的分析视角解决问题的一般思路和方法,构建思维模型。通过思维模型构建使学生能借助已有的学科知识、学科思维、学科观念解决特定知识领域的问题,进而帮助学生认识化学学科的本质特征,培养逻辑推理能力,提升其学科核心素养。
沉淀溶解平衡是物质在水溶液中的一种化学平衡,高考中常常涉及沉淀的溶解、生成与转化,溶度积的计算,沉淀溶解平衡图像的分析等。沉淀溶解平衡图像涉及内容范围广,考查形式多变。为有效突破图像分析的难点,笔者以“沉淀溶解平衡图像”的习题课为例,通过“问题导学”构建相关沉淀溶解平衡图像模型,促进学生的深度学习。
一、创设问题情境,重温沉淀溶解平衡知识
沉淀溶解平衡图像的教学有利于学生全面、深入地认识物质在水溶液中的平衡理论,有利于发展学生的微粒观、变化观和平衡观,有利于学生从宏微结合的视角认识问题、分析问题、解决问题,发展“宏观辨识与微观探析”学科核心素养。在“沉淀溶解平衡图像”的习题课中,可通过问题情境教学灵活运用各种教学手段和策略,设置多个递进式问题,构建思考方向,充分调动学生的主观能动性,使学生深度认识沉淀溶解平衡的本质,培养学生的思维能力、数学推理能力。
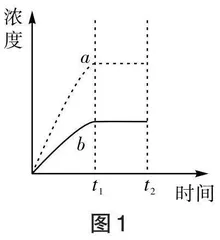
【例1】已知Ag2SO4的Ksp为2.0×10-5,将一定量的Ag2SO4固体溶于100 mL水中达饱和状态,溶液中Ag+和SO[2-4]的浓度随时间变化关系如图1所示。
(已知:[23]≈1.26,[53]≈1.71)
请回答下列问题:
①图1中表示Ag+浓度随时间变化关系的曲线是 。
②[t1]时溶液中Ag+和SO[2-4]的浓度分别为:[c(Ag+)]= ,c(SO[2-4])= 。
③若[t2]时向溶液中加入100 mL水(混合后忽略溶液体积变化),则[t2]后曲线[a]、[b]将如何变化,请绘制离子浓度随时间变化的曲线。
④若[t2]时向溶液中加入Na2SO4(s),则溶液中的Ag+和SO[2-4]浓度将如何变化,请绘制离子浓度随时间变化的曲线。
⑤若[t2]时向溶液中加入100 mL 0.01 mol/L Na2SO4溶液(混合后忽略溶液体积变化),判断是否有Ag2SO4沉淀生成,请写出判断过程。
通过问题①和问题②使学生重温沉淀溶解的过程,同时关注溶液中微粒浓度间的数量关系,运用溶度积常数Ksp进行定量计算。问题③涉及加水对沉淀溶解平衡的影响,在教学过程中教师结合问题①和问题②的定量关系组织学生进行小组合作交流,使学生在分析过程中形成数形结合的思维,提升解决相关问题的能力。在问题③的分析、讨论过程中,学生往往会绘制出如图2和图3所示的两种不同的图像,进而引发认知冲突。此时,教师可提问学生得出这两种图像的理由,并引导学生进一步思考和讨论。学生通过自主分析得出:若[t1]时固体恰好完全溶解达到饱和状态则加水后离子浓度变化如图2所示;而[t1]时若还有较多未溶解的固体,则加水后固体会继续溶解,离子浓度变化如图3所示。通过问题分析,使学生关注溶质是否完全溶解对加水后所得溶液的离子浓度的影响及相关的数量关系。
在解决问题③的基础上,教师结合问题④进行分析和梳理,巩固条件的变化对沉淀溶解平衡的影响,并从定量的角度构建图表(如图4)解释沉淀溶解平衡的相关现象。对于问题④,教师可引导学生分析加入Na2SO4粉末后溶液中的离子浓度变化情况,并将图像的横纵坐标分别调整为c(Ag+)和[c(SO2-4)],再次让学生结合Ksp的表达式绘制溶液中的离子浓度变化曲线(如图5),从而实现知识的延伸和拓展。对于问题⑤,可先让学生对比其与问题④的差异,进而分析混合后溶液中c(Ag+)和c(SO[2-4])的变化情况,通过Q与Ksp的比较判断是否有沉淀生成,促进学生对沉淀溶解平衡知识的掌握与理解。
上述问题的解决过程,自始至终是一个思维的过程。在教学过程中创设问题情境,以学生的思维发展为目标,引导学生通过提取题干中的关键要素,形成认知规律,掌握该领域核心知识的认知角度和思路,形成化学思维,提升科学探究能力。
二、深化知识整合,构建沉淀溶解平衡图像模型
《普通高中化学课程标准(2017年版2020年修订)》将“模型认知”核心素养表述为:知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。认知模型是用模型化的方法处理化学知识发生和发展的过程,提取知识认知过程中的特征和规律,获得高度概括化、结构化的核心知识。模型的构建能有效促进学生整合已有知识解决特定知识领域问题,并深化对所学知识的理解,形成解决问题的思路和方法,发展模型认知思维。
教师通过例1沉淀溶解平衡过程中离子浓度变化的教学,引导学生自主归纳、总结沉淀溶解平衡图像的分析方法和规律,构建如下分析沉淀溶解平衡图像类习题的思维模型。
(一)提取题干信息,分析溶液状态
1.一定温度条件下,将固体物质溶解于一定量的水中,所得溶液中的阴、阳离子浓度关系与溶质的化学式密切相关。因此,在题干分析过程中应重点关注溶质的化学式,进而确定溶液中阴、阳离子间的数量关系。
2.提取题干信息时应明确所涉及的溶液是否达到沉淀溶解平衡状态。若该溶液已达到沉淀溶解平衡状态,可根据溶液中的阴、阳离子浓度并结合溶度积表达式得出在此温度条件下该溶质的溶度积常数(Ksp)。反之,若已知溶度积常数也可推算出该溶液中阴、阳离子的浓度。
3.提取题干信息时还应明确所得溶液中是否还存在未溶解的溶质,若存在未溶解的溶质说明该溶液已达到沉淀溶解平衡状态。在温度不变的条件下,向该溶液中加入少量水,则未溶解的溶质将继续溶解,溶液重新达到饱和状态时的阴、阳离子浓度与原溶液中的阴、阳离子浓度相同。
(二)关注图像坐标,厘清曲线变化
在分析沉淀溶解平衡图像时,应先确定图像的横纵坐标所表示的物理量。沉淀溶解平衡图像的坐标可能是离子浓度、离子浓度的对数或负对数,也可能是加入的溶液体积等,不同的物理量所对应的图像曲线会存在差异。因此,在图像分析过程中应优先关注横纵坐标所表示的物理量。
(三)抓住溶度积常数,进行定量分析
溶度积常数只受温度的影响,与溶液的离子浓度无关。在温度不变的条件下,沉淀溶解平衡中若改变其中一种离子的浓度,另一种离子的浓度也会随之改变,但是其阴、阳离子浓度的变化只能沿着平衡曲线,而不会出现在曲线外。如图5所示,曲线上的任意点都处于沉淀溶解平衡状态,此时[Q=] Ksp;当[Q>] Ksp时(即曲线右上方),溶液处于过饱和状态,此时会有溶质析出;当[Q<] Ksp时(即曲线左下方),溶液处于不饱和状态,此时溶液会继续溶解溶质。在进行混合溶液的分析时,Q的表达式所代入的离子浓度必须是混合后所得溶液的离子浓度,计算离子浓度所用的体积应为混合溶液的体积。通过Q与Ksp的比较,可判断溶液是否达到沉淀溶解平衡状态。
沉淀溶解平衡图像模型的构建,可以使学生多角度、全方位地认识沉淀溶解平衡以及沉淀溶解和沉淀生成的本质,使庞杂的知识系统化、结构化,并使其与问题建立联系,将知识转化成解决问题的思路和方法。
三、强化模型应用,解决沉淀溶解平衡问题
模型是以客观事实为依据建立起来的,是对事物及其变化所做的一种简化描述或模拟。沉淀溶解平衡图像模型的构建使学生更易于掌握沉淀溶解平衡图像分析的基本方法和思路,而能否熟练地运用模型则直接影响学生学习的效率。教学过程中教师可通过练习引导学生进行由浅入深的进阶学习,在模型的基础上对知识进行内化和提升,并用于解决新问题,在新问题的解决过程中深化对模型的理解,促进学生构建知识结构,厘清思路,建立联系,拓展延伸。
【练习1】硫酸钙是锅炉垢的主要成分,由于导热性能差,锅炉垢极易引起锅炉爆炸事故,所以需要定期进行处理。通常处理的方法为先用碳酸钠溶液浸泡,再用稀盐酸或醋酸处理。已知:25 ℃时,CaSO4的[Ksp =9.2×10-6] ,CaCO3的[Ksp=2.8×10-9],CaCO3和CaSO4的沉淀溶解平衡曲线如图6所示。请回答以下问题:
①图中表示CaSO4沉淀溶解平衡曲线的是 。(填“N”或“M”)
②图中x1、x2两点的值分别为 、 。
③用碳酸钠溶液浸泡锅炉垢的过程中能否实现图中[b]点到[a]点的转化,并说明理由。
④用碳酸钠溶液浸泡锅炉垢的原理为:CaSO4(s)+CO[2-3](aq)⇌CaCO3(s)+SO[2-4](aq),25 ℃时该反应的平衡常数K= 。
⑤向上述平衡体系中加入少量Na2CO3(s),则c(SO[2-4])/ c(CO[2-3])的值 。(填“变大”“变小”或“不变”)
⑥若向饱和CaCO3溶液中加入Na2SO4(s),当测得[c(SO2-4)=1.0 mol/L]时,溶液是否有CaSO4析出,请写出分析过程。
学生结合沉淀溶解平衡图像模型对练习1开展如下分析:
1.题中物质对象为CaCO3和CaSO4,由化学式可知两者的阴、阳离子个数比为1∶1,可得其Ksp(CaX)=c平(Ca2+)·c平(X2-),同时题中已知两种沉淀的溶度积常数。
2.图像横坐标为阴离子浓度,纵坐标为阳离子浓度,分析图像中[a]、[b]两点c(Ca2+)相同,阴离子浓度[x2>x1],对比Ksp的大小便可找出两条沉淀溶解平衡曲线所对应的溶质。