基于模型建构的有机物结构与性质教学设计研究
作者: 雷周
[摘 要]建构有机物结构与性质分析模型,有利于培养学生的“证据推理与模型认知”核心素养,领悟有机物学习的思路和方法。文章以“羧酸的结构与性质”的教学为例,在深入分析其对促进学生学习有机物的教学价值的基础上,基于模型建构理论,通过模型发展、模型精细化、模型迁移和模型重建四个阶段完成教学设计与实施探究,并结合学生的课堂表现和课后反馈,总结本研究的结论和教学启示。
[关键词]模型建构;有机物;结构;性质;羧酸;教学设计
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2023)11-0079-04
有机物种类、性质繁多,熟记每种有机物的性质是高中生化学学习的难点,而基于官能团建构有机物结构与性质分析模型对学生掌握各类有机物的性质具有重要意义。《普通高中化学课程标准(2017年版)》指出,通过有机化学基础模块的学习,引导学生建立“组成、结构决定性质”的基本观念,形成基于官能团、化学键与反应类型认识有机化合物的一般思路[1]。
“结构决定性质”是有机化学的核心思想,如何将其内化为学生学习有机化学的指导思想是目前高中化学教学亟待解决的问题。在学习有机化学的过程中,不少学生对于有机物性质的学习还停留在机械记忆阶段。部分教师在教学过程中侧重于对碳原子的成键方式、共价键的类型等概念进行解读,但没有深入探究这些概念在有机物性质分析中的重要作用,造成学生对知识的整体性认识不足,不能形成有机物系统分析模型,无法实现从“记知识”到“用知识”的转变。虽然教师都会强调 “结构决定性质”对学好有机化学的重要性,但较少从模型建构的角度进行教学设计。建构有机物结构与性质分析模型,可以帮助学生将“结构决定性质”内化于心,形成一套解释、推断有机物性质的完整模型。
基于上述背景,本文以“羧酸的结构与性质”的教学为例,通过对以素养为本的“四阶段八环节”模型建构理论的分析与应用实践,探索基于有机物结构与性质分析模型的教学设计与实施策略。
一、有机物结构与性质分析模型建构理论基础
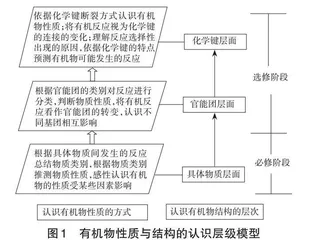
北京师范大学的王磊教授基于学生的认知发展规律,结合高中化学有机化学基础模块的知识特点,将学生对有机物的认识划分为基于具体物质及类别的认识、基于官能团的认识和基于化学键的认识3个水平层级,并分析不同水平层级之间的关系。有机化学基础模块要求学生学会从化学键视角认识有机物的结构与性质。化学键最能反映有机物的结构特点,能从本质上揭示各类有机化学反应的规律,有利于学生理解 “结构决定性质”的学科思想。陈欣在肖红的研究基础上,建立了有机物性质与结构的认识层级模型(如图1)[2]。该模型清晰地描述了学生认识有机物的各发展层级。
[认识有机物性质的方式] [依据化学键断裂方式认识有机物性质;将有机反应视为化学键的连接的变化;理解反应选择性出现的原因,依据化学键的特点预测有机物可能发生的反应][根据官能团的类别对反应进行分类,判断物质性质,将有机反应看作官能团的转变,认识不同基团相互影响][根据具体物质间发生的反应总结物质类别,根据物质类别推测物质性质,感性认识有机物的性质受某些因素影响][认识有机物结构的层次][具体物质层面][官能团层面][化学键层面][选修阶段][必修阶段]
图1 有机物性质与结构的认识层级模型
教材罗列了有机物结构的相关概念,但未解释结构与性质的关联,没有将二者联系起来,使得这些结构概念的深层次含义及其在认识有机物性质方面的作用没有充分发挥出来,不利于学生从整体上认识有机物的结构与性质。因此,在有机化学基础模块的教学设计上,有必要先帮助学生建构有机物结构分析模型(如图2),引导学生从原子之间的化学键的角度去分析有机物的结构,应用模型将化学键和有机物的结构、性质联系起来,形成有机物分析的一般模型,充分发挥核心概念的功能。
[共价键的极性][碳原子的饱和程度][邻近基团对化学键的影响][化学键角度][官能团角度][有机
化合
物的结构][官能团相互作用][官能团类型]
图2 有机物结构分析模型
模型建构需要经历一些复杂的环节,刘俊庚、邱美虹等人在模型建构的研究基础上提出了“四阶段八环节”建模理论,具体内容如表 1 所示[3]。
表1 “四阶段八环节”建模表
[阶段 环节 环节诠释 作用 模型发展阶段 模型选择 选择适切的模型对象 以澄清问题为导向 模型建立 基于模型对象建立成分关系与结构 初步架构、表征模型 模型精细化阶段 模型效化 效化成分间的关系与结构,确立内部一致性 操作模型,观察关系,支持解释 模型分析 利用已效化的模型对问题进行解释与分析 分析预测结果与证据之间的一致性 模型迁移阶段 模型应用 将已效化的模型应用于相似问题情境中 近迁移,验证模型适切性 模型调度 将已效化的模型应用于新情境中 远迁移,突破模型限制 模型重建阶段 模型修正 察觉模型部分失效,增加或减少成分与关系,修正为新模型 弱重建,强化或延伸模型 模型转化 察觉模型整体失效,重新建立新的模型 强重建,发展更强的模型 ]
综上可知,模型的建构可分为模型发展、模型精细化、模型迁移、模型重建四个阶段,具体分为模型选择、模型建立、模型效化、模型分析、模型应用、模型调度、模型修正、模型转化八个环节。结合有机物结构与性质的具体教学内容,则主要围绕官能团与化学键两个维度来展开模型建构。
二、羧酸结构与性质教学价值分析
“羧酸的结构与性质”选自2019年鲁科版高中化学选择性必修3《有机化学基础》第二章第四节第二课时,通过必修第二册和本模块前面内容的学习,学生对有机物结构与性质的关系、有机化学反应类型已有丰富的知识积累和较为深刻的理解,掌握了分析有机物结构的方法;通过醇的学习掌握了羟基的性质,通过醛、酮的学习掌握了羰基的性质,通过了苯酚的学习知道了官能团之间存在相互影响。本节课改变以往直接讨论羧基化学性质的教学方法,以最常见的羧酸——乙酸为例,引导学生充分运用已有知识,回忆乙酸的性质,并从断键的角度对乙酸的性质进行分析,再结合羧基官能团的结构特点,将羧基与前面学过的羰基和羟基进行比较,得出三者性质上的相似性,理解由于官能团之间的相互影响而体现出的差异性。因此,本节课不仅是对羧酸化学性质的学习,更是对烃的衍生物官能团以及有机反应的总结提升与应用。
三、基于模型建构的教学设计与实施
(一)模型发展
[创设情境]播放有关中国醋文化的视频,引导学生回忆必修第二册中所学的乙酸化学性质。
学生1:乙酸能与金属钠等活泼金属反应,能与酸碱指示剂作用,能与碱、碱性氧化物、某些盐等反应,具有酸的通性。
学生2:能与乙醇发生酯化反应。
[提出问题]如何判断乙酸、碳酸、苯酚的酸性的强弱?请利用如图3所示的实验装置设计实验进行验证。(乙酸、碳酸、苯酚的电离平衡常数参照表2的数据)
[苯酚钠溶液] [饱和
NaHCO3溶液] [CH3COOH][Na2CO3] [A B C]
图3 实验装置图
表2 乙酸、碳酸、苯酚电离平衡常数
[物质 CH3COOH H2CO3 C6H5OH Ka1 1.8×10-5 4.2×10-7 1.1×10-19 Ka2 5.6×10-11 ]
[实验探究]学生设计实验并进行验证,实验装置如图4所示。
[小结]因乙酸的酸性强于碳酸,则向Na2CO3固体中滴入乙酸溶液可产生CO2气体(乙酸易挥发,CO2气体中混有乙酸蒸气,可用饱和NaHCO3溶液除去)。将CO2气体通入苯酚钠溶液中,溶液变浑浊,说明碳酸的酸性强于苯酚。
[提出问题]前面提到的酯化反应的实质是什么呢?
学生3:酸脱羟基醇脱氢。
[小结]乙酸的化学性质与断键位置有关。基于有机物的结构分析去理解有机物的化学性质,是学习有机物的重要方法。
设计意图:引导学生从乙酸能与金属钠等物质反应的事实中提取证据,对羧酸的有关化学性质提出假设;从电离平衡常数的角度认识不同弱酸的酸性强弱;理解酯化反应的本质在于酸脱羟基醇脱氢,识别有机物官能团和有机物性质的理论模型,将化学事实和理论模型之间进行关联和合理匹配。
(二)模型精细化
[引导思考]根据乙酸的结构式分析乙酸可能断键的位置,并预测乙酸的化学性质。
[学生活动]画出乙酸结构中可能断键的位置,并分析对应的化学性质。
学生4:①处可在水分子作用下断键,电离出氢离子,体现乙酸的酸性;②处断键可发生酯化反应。
[引导思考]我们可以判断一下乙酸中碳、氢、氧元素的电负性,标出不同元素的电性分布情况,分析一下化学键的极性情况,思考它们对应的化学性质。
学生5:③处断键可以发生加成反应,④或⑤处断键均可发生取代反应。
[交流讨论]实际上③处的化学键不易断裂,较难发生加成反应,为什么呢?羰基右边连接的是什么基团?羟基是吸电子基,在羟基的影响下,羰基上的双键只有在如氢化铝锂等强还原剂的作用下才会断裂,发生还原反应。同理,羧基也是一个吸电子基,在羧基的作用下α-碳上氢原子的极性会增强,容易发生α-H取代反应。④处化学键极性减弱,也不容易断键,一般要在氧化钙和氢氧化钠的作用下才可以发生脱羧反应。
[小结]通过上面的讨论,我们可以获得分析有机物结构与性质的一般方法。
第一步,寻找官能团。官能团是代表一类有机物性质的原子或原子团,找到了官能团就能知道该有机物具有什么主要性质。
第二步,分析官能团之间的相互影响。不同官能团之间存在着一定的影响,该影响会使有机物表现出不同于单一官能团的特殊性质。理解官能团之间的相互影响,有助于理解有机物的整体性质。
第三步,判断断键位置。化学反应的实质在于旧键的断裂和新键的形成,只有学会分析断键位置,才能理解有机物性质的本质所在。
设计意图:引导学生进一步思考乙酸化学性质与乙酸断键位置的联系,知道不同位置断键体现不同化学性质,体会有机物结构与性质分析的关键在于判断断键位置。
(三)模型迁移
[引导思考]由乙酸过渡到羧酸,认识羧酸的结构特点(如图6),并应用有机物结构与性质的分析模型来学习其他羧酸的化学性质。
[迁移应用]甲酸是组成最简单的羧酸,结构简式为HCOOH,它最早是从蚂蚁体内提取出来的,故又称蚁酸。甲酸是有刺激性气味的无色液体,有腐蚀性,能与水、乙醇、乙醚、甘油等互溶。甲酸在工业上还可以做还原剂,在医疗上可做消毒剂。尝试根据甲酸的结构分析甲酸的化学性质。