血浆miR-204在冠心病患者中的表达及其临床意义
作者: 李斯 尹明洁 米颖 孙雅楠
【摘要】 目的 检测冠心病(CHD)患者血浆中miR-204的表达水平,评估血浆miR-204对于CHD的诊断价值。方法 首先选取2018年1月- 2020年1月医院就诊的CHD患者30例为CHD组,健康人员28例为对照组。应用实时荧光定量PCR方法,检测miR-204因子在两组血浆中的表达水平;其次应用受试者工作特征曲线(ROC),进一步分析血浆miR-204对于CHD的诊断价值。结果 CHD组患者血浆miR-204的水平显著低于对照组,组间差异有统计学意义(P<0.05);血浆miR-204用于诊断CHD的ROC曲线下面积(AUC)=0.717(95%CI:0.575~0.858)。当临界值为0.00075;血浆miR-204诊断CHD灵敏度=53.333%,特异度=100.000%,Kappa=0.523。诊断结果与实际结果中高度一致,具有临床应用价值,但漏诊率较高。结论 CHD患者血浆miR-204的表达水平显著降低,当血浆miR-204>0.00075诊断CHD时,具有一定临床参考价值,但需注意漏诊率偏高。
【关键词】 miR-204;冠心病;实时荧光定量PCR;受试者工作特征曲线
中图分类号 R541.4 文献标识码 A 文章编号 1671-0223(2023)03--03
microRNA(miRNA)具有调节生长发育、调整机体生理病理状态的微小RNA。miRNA在正常状态下,稳定的存在于人体的循环系统及组织细胞中[1-2]。miR-204是miRNA家族成员之一,目前研究表明其在心血管系统中表达,发挥调节血管细胞功能的作用[3]。冠心病(CHD)患者由于血管管腔狭窄往往会引发一系列临床症状,其血浆miR-204表达水平是否会发生变化尚未见报道。本研究通过与健康人对比,分析CHD患者血浆miR-204表达水平,旨在探讨血浆miR-204在CHD疾病中的变化以及用于CHD无创诊断的可能性。
1 对象与方法
1.1 研究对象
选取2018年1月- 2020年1月医院就诊的CHD患者30例为CHD组(病例组)。纳入标准:符合2011《美国心脏学会及美国心脏病学会不稳定型心绞痛/非ST段抬高心肌梗死指南》诊断标准,并且冠状动脉造影结果提示冠状动脉血管直径狭窄程度≥50%的血管至少1支。排除标准:先天性心脏病患者、心脏瓣膜受累型疾病患者、严重的充血性心力衰竭患者;患者伴有肝脏、肾脏、免疫性的疾病,以及恶性肿瘤性疾病、血栓性疾病,以及出血性的疾病等;近期伴有各种急慢性的炎症疾病患者或者是大型创伤性损伤血管的疾病等情况。同期选择年龄、性别等与病例组相匹配的健康人员28例为对照组。本研究由医院伦理委员会批准通过,所有研究对象均签署了知情同意书。
1.2 实验室检测方法
(1)标本的采集:早8点冠状动脉造影之前,空腹行肘静脉采血收集血标本。
(2)血浆中总RNA的提取:本研究使用mirVana Paris Kit反应试剂盒,根据说明书逐步提取标本血浆中的总RNA,实验后标本放置于-80℃的冰箱冻存保留。
(3)cDNA的合成:应用实时荧光定量PCR(Taqman探针法),首先配置RT-PCR的反应体系,其中10×buffer是0.8μl、RNA 4.5μl、dNTP 0.2μl、抑制剂为 0.1μl、无水的RNase 0.4μl、RNA 引物 为1.5μl、RTase 0.5μl,总反应体系为8μl充分摇匀,全过程需在冰浴上操作。反应条件设置为:16℃60 min、42℃60 min、85℃5 min、4℃下保持循环。
(4)RT-PCR 配置:反应体系为:2×TaqMAN universal PCR Master MIX为10μl、无水RNase 5μl、TaqMAN 探针 1μl、cDNA为 4μl,总反应体系为20μl,设定的反应条件为:首先起始模板预变性95℃10 分钟,中模板变性95℃15 秒、60℃60秒进行退火的循环共40次;每个实验的样本均做一个副管,每个实验重复3次,记录每次实验的CT值,取平均值,后期经2-∆CT转换。
1.3 统计学方法
采用SPSS 17.0以及GraphPAD Prism 5.0 统计软件对数据进行分析及作图。计数资料计算百分率,两组间率比较采用卡方检验;正态分布的计量资料使用“±s”表示,两组间均数比较采用独立样本t检验;非正态分布的计量资料用“M(P25,P75)”来表示,两组间中位数比较采用Kruskal-Wallis秩和检验。双侧检验,P<0.05为差异具有统计学意义。
2 结果
2.1 两组研究对象基本特征比较
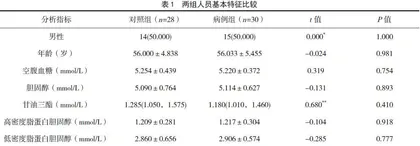
病例组与对照组之间性别、年龄、空腹血糖、胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇水平比较,差异均无统计学意义(P>0.05),见表1。
2.2 两组血浆miR-204的表达水平比较
对照组血浆miR-204表达水平明显高于病例组,差异有统计学意义(P<0.05),见表2,表明CHD患者血浆miR-204表达水平显著降低。
2.3 血浆miR-204水平用于CHD诊断的效能
ROC分析结果显示,血浆miR-204水平用于CHD诊断的AUC=0.717(95%CI:0.575~0.858),说明血浆miR-204具有一定的CHD诊断效能,见图1。根据约登指数最大原则,筛选出血浆miR-204诊断CHD的临界值为0.00075(2-∆CT转换后)。
2.4 血浆miR-204用于CHD的诊断结果
以血浆miR-204表达水平(2-∆CT转换后)< 0.00075为诊断CHD的标准,诊断结果见表3。结果显示,血浆miR-204诊断CHD灵敏度53.333%,特异度100.000%, Kappa值为0.523,表明诊断结果与实际结果具有中高度一致性,具有临床应用价值,但漏诊率过高。
3 讨论
miRNA是一类广泛存在人体各组织细胞及循环系统中的非编码小RNA , miRNA的存在具有相对较高的稳定性,如在反复冻融过程中(4~-80℃)、血浆酸碱度水平的变化以及裂解酶存在的条件下,研究证实其不易被降解破坏,报道证实其能够比较稳定地存在[4]。miRNA的研究领域之前在衡量miRNA重要性的研究,目前发展到专注于特定miRNA子集的研究,包括这些特定miRNA对于系统稳定和病理生理条件的有效调节因子,以上特点使血浆miRNA研究逐步精细化及标准化。
miR-204是miRNA家族成员之一,我们前期回顾了其分子特征和调节作用,证据表明miR-204在调节心血管生理学和病理生理过程中发挥重要作用,并且miR-204表现出高度组织特异性的表达模式,受多种转录和转录后机制的调控[5]。有研究证实miR-204在减轻肺动脉高压和高血压中的作用,同时在广泛的模型系统中促进高血压和内皮功能障碍。miR-204可能通过以组织特异性的方式靶向几种生物途径来影响这些疾病过程[6]。miR-204在心血管和肾脏疾病中是一种高价值的miRNA。
冠心病即为冠状动脉粥样硬化性心脏病,据统计发现当今世界CHD的发病率与死亡率在发达及发展中国家已经超过肿瘤性疾病、传染性疾病等,成为成人首要的死亡原因之一[7]。CHD的患者极易发展为不稳定型心绞痛、慢性稳定型心绞痛及急性心肌梗死等严重疾病,病死率极高,加重家庭负担及社会医疗资源的极大负担,严重影响人类的生存质量[8]。对于CHD患者早期识别早期诊断是当今医师面临的社会责任,做好CHD的预防与早期识别有助于患者早期就诊,早期治疗,预防重症疾病的发生。
CHD早期识别的血浆血因子研究较多,miRNA在CHD的研究也有报道,表明在CHD发病所相关血管管腔狭窄及炎症反应过程中,血浆中多种miRNA的表达水平相较于正常状态会发生波动,并且研究进一步证实,表达水平的变化与冠状动脉病变的严重程度可能具有一定关系。目前研究表明miR-204具有抑制心肌损伤的作用,其机制可能是直接抑制炎症因子白介素的表达[9]。还有学者研究miR-204在颈动脉粥样硬化患者血浆中的表达,并对其作用机制研究表明,其可能抑制ox-LDL诱导的巨噬细胞胆固醇积累和凋亡发挥抑制动脉硬化的作用[10]。在人类受试者和啮齿类动物中研究表明miR-204表达水平是肺动脉高压发生的生物标志物,并且与肺动脉高压的严重程度相关[11-12]。最近,有学者[13]的研究显示,在肺动脉高压患者外周血细胞中miR-204在肺血管血液循环系统和细胞内表达显著减少。在1型糖尿病研究中发现循环miR-204水平也发生显著变化。其可能在细胞外液中的细胞间信号传导及蛋白表达调节发挥作用。对于miR-204在冠心病患者血浆中的表达水平研究显示,CHD组患者血浆miR-204水平显著低于对照组,并且通过ROC曲线分析表明miR-204对于CHD的诊断价值曲线下面积(AUC)= 0.717(95%CI:0.575~0.858,P<0.05)临界值为0.00075;血浆miR-204诊断CHD灵敏度53.333%,特异度100.000%,Kappa值为0.523,表明诊断结果与实际结果具有中高度一致性,具有临床应用价值,但漏诊率过高。
4 参考文献
[1] Bartel DP. MicroRNAs:Genomics,biogenesis,mechanism,andfunction[J]. Cell,2004,116(2):281-297.
[2] Sevignani C,Calin GA,Siracusa LD,et al.Mammalian microRNAs:A small world for fine-tuning gene expression[J].Mammalian Genome,2006,17(3): 189-202.
[3] Ludwig N,Leidinger P,Becker K,et al.Distribution of miRNA expression across human tissues[J].Nucleic Acids Res,2016,44:3865-3877.
[4] Valli AA,Santos BA,Hnatova S,et al.Most microRNAs in the single-cell alga Chlamydomonas reinhardtii are produced by Dicer-like 3-mediated cleavage of introns and untranslated regions of coding RNAs[J].Genome Res,2016,26(4):519-529.
[5] Rie D,Abugessaisa I,Alam T,et al.An integrated expression atlas of miRNAs and their promoters in human and mouse[J].Nat Biotechnol, 2017,35:872-878.
[6] Jing Liu,Yong Liu,Feng Wang,et al.miR-204:Molecular regulation and role in cardiovascular and renal diseases[J].Hypertension,2021,78(2):270-281.
[7] Go AS,Mozaffarian D,Roger VL,et al.Heart disease and stroke statistics 2014 update a report from the American Heart Association[J] Circulation, 2014,129(3):e28-e292.
[8] 陆在英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008.
[9] 于兆海,于悦.粗糠柴毒素上调微小RNA-204-5p对脂多糖所致心肌损伤的保护机制研究[J].安徽医药,2022,26(12):2368-2374.
[10] 张丽丽,梁娜娜.miR-204在颈动脉粥样硬化患者血浆中表达及其在ox-LDL诱导的巨噬细胞胆固醇积累和凋亡中的调控作用[J].中国老年学杂志,2022,42(20):5107-5110.
[11] Courboulin A,Paulin R,Giguere NJ,et al.Role for miR-204 in human pulmonary arterial hypertension[J].J Exp Med,2011,208:535-548.
[12] Estephan LE,Genuardi MV,Kosanovich CM,et al.Distinct plasma gradients of microRNA-204 in the pulmonary circulation of patients suffering from WHO Groups I and Ⅱ pulmonary hypertension[J].Pulm Circ,2019,9(2):646.
[13] Latronico MV,Condorelli G.MicroRNAs and cardiac pathology[J].Nat Rev Cardiol,2009,6:419-429.
[2022-12-16收稿]