气相色谱-串联质谱法测定茶叶中的蒽醌残留量
作者: 黄旭
摘 要:目的:建立一种使用QuEChERS提取、分散固相萃取净化,气相色谱-串联质谱法测定茶叶中蒽醌残留量的方法。方法:样品加入同位素内标后,采用乙腈提取,加入盐包盐析分层,提取液经分散固相萃取净化,进一步稀释后进入气相色谱质谱联用仪进行分析。结果:蒽醌在0~200 ng·mL-1浓度范围内呈现良好线性关系,线性相关系数大于0.995,定量限为0.01 mg·kg-1;3种不同茶叶样品基质在3个不同加标水平下的蒽醌回收率在90.2%~98.5%,相对标准偏差均小于3.0%。结论:该方法具有稳定、快速、重现性好等特点,能够满足茶叶中蒽醌残留分析的需求。
关键词:茶叶;蒽醌;QuEChERS;气相色谱-串联质谱法
Abstract: Objective: To establish a method for the determination of anthraquinone residues in tea by QuEChERS extraction, dispersion solid phase extraction and gas chromatography-tandem mass spectrometry. Method: After adding isotope internal standard, the sample was extracted with acetonitrile, salt coated salting out and layering, and the extract was purified by dispersive solid phase extraction, further diluted, and then analyzed by gas chromatography-mass spectrometry. Result: Anthraquinone showed a good linear relationship in the concentration range of 0 ng·mL-1 to 200 ng·mL-1, the linear correlation coefficient was greater than 0.995, and the quantitative limit was 0.01 mg·kg-1. The recoveries of anthraquinone in three different tea sample matrices at three different spiked levels were between 90.2% and 98.5%, and the relative standard deviation was less than 3.0%. Conclusion: The method is stable, rapid and reproducible, and can meet the needs of anthraquinone residue analysis in tea.
蒽醌,又名9,10-蒽二酮,是一种有机化合物。2017年10月27日,世界卫生组织国际癌症研究机构将蒽醌列在2B类致癌物清单中。目前,国内市场在售的茶叶中蒽醌的检出率较高,应当引起足够的重视[1]。茶叶加工过程燃烧煤和柴产生的烟雾是茶叶中蒽醌的主要污染源。目前,茶叶中蒽醌残留量的检测方法主要是气相色谱-串联质谱法。但由于茶叶种类较多,基质较为复杂,提取液中复杂基质会在上机过程中产生严重的基质效应,且对离子源造成污染,因此在茶叶中蒽醌检测前处理过程中,蒽醌提取液中基质的净化显得尤为重要。茶叶中蒽醌检测前处理过程中,固相萃取净化、凝胶色谱净化以及在线凝胶色谱净化等均是较为常用的净化手段。其中,固相萃取净化法处理过程需要氮吹、旋蒸等浓缩手段。凝胶色谱净化处理过程采用了单通道的前处理方式。对大批量的样品前处理来说,这两种方式均较为繁杂,效率较低,而且实验过程中会使用大量的有机试剂,对实验人员的健康不够友好。另外,大多数实验室未配备在线凝胶色谱净化设备。鉴于此,本文采用实验室较为普及的QuEChERS提取、分散固相萃取的净化方式,免去浓缩过程,可大幅度减少有机溶剂的用量,且实验过程易于操作,适用于大批量茶叶样品的蒽醌残留量检测。
1 材料与方法
1.1 材料与试剂
红茶、绿茶及乌龙茶,辽宁省食品检验检测院某批次检验的余样,且样品在保质期内,符合检验要求。蒽醌(标准物质原液浓度1 000 μg·mL-1),ALTA公司;蒽醌-D8(标准物质原液浓度1 mg·mL-1),PANPHY公司;色谱纯乙腈,沃凯公司;佛罗铝硅土,COPURE公司。
1.2 仪器与设备
Sin-QuEChERS Nano茶叶专用净化柱,北京绿绵科技有限公司;QuEChERS盐包、净化包,山东青云实验耗材有限公司;Milli-Q型超纯水机,密理博公司;Multi Reax旋涡混合器,海道夫公司;电子天平(精度为0.000 1 g),梅特勒-托利多公司;Multifuge X1R高速离心机,THERMO公司;GCMS-TQ8040气相色谱质谱联用仪,岛津公司。
1.3 标准溶液配制
准确移取浓度为1 000 μg·mL-1的蒽醌标准物质原液1.0 mL于10 mL容量瓶中,使用乙腈定容至标线,得到浓度为100 μg·mL-1的蒽醌标准中间液。准确移取浓度为100 μg·mL-1的蒽醌标准中间液1.0 mL于100 mL容量瓶中,使用乙腈定容至标线,得到浓度为1 000 ng·mL-1的蒽醌标准中间液。
准确移取浓度为1 mg·mL-1的蒽醌-D8标准物质原液10 μL于50 mL容量瓶中,使用乙腈定容至标线,得到浓度为200 ng·mL-1的蒽醌-D8标准中间液。
分别取6支10 mL容量瓶,加入200 ng·mL-1的蒽醌-D8标准中间液0.5 mL,再分别加入0、0.1、0.2、0.5、1.0 mL和2.0 mL浓度为1 000 ng·mL-1蒽醌标准中间液,使用乙腈定容至标线,配制成浓度为0、10、20、50、100 ng·mL-1和200 ng·mL-1的标准工作曲线。
1.4 样品前处理
称取茶叶试样2 g(精确至0.01 g)于50 mL离心管中,加入浓度为200 ng·mL-1的蒽醌-D8标准中间液0.5 mL和10.0 mL纯净水,浸泡10 min。在上述浸泡液中准确加入10.0 mL乙腈,加入陶瓷均质子,扣紧盖子后,上下摇晃30 s,高速旋涡10 min。加入QuEChERS盐包进行分层,再次旋涡1 min,离心机8 000 r·min-1离心5 min。吸取6 mL上层乙腈到QuEChERS净化管中,加入1 g佛罗铝硅土粉末,扣紧盖子后,手动摇晃均匀,然后旋涡5 min,让净化材料与乙腈充分接触,8 000 r·min-1离心5 min。准确吸取1.0 mL净化液于10 mL离心管中,使用乙腈定容至10 mL,充分混匀后过0.22 μm滤膜,上机进行测定。
1.5 色谱和质谱条件
(1)气相色谱条件。色谱柱:HP-5MS UI(30 m×0.25 mm,0.25 μm);柱温:100 ℃,保持1 min,以20 ℃·min-1的速率升温至300 ℃,保持0 min;进样口温度:300 ℃;载气:高纯氦气,流速1 mL·min-1,恒流方式;进样量:1 μL。
(2)质谱条件。接口温度:300 ℃;离子源:电子轰击源,70 eV;离子源温度:280 ℃;扫描方式:多反应监测(Multi Reaction Monitoring,MRM)。化合物离子对:蒽醌定量离子208.0>180.0,碰撞能量10 eV,定性离子碰撞能量30 eV;蒽醌-D8定量离子215.9>188.0,碰撞能量10 eV。
2 结果与分析
2.1 提取方式优化
茶叶含水量较低,在5%~8%[2],直接使用有机溶剂提取,溶剂无法完全浸透样品,会造成检测结果偏低。本实验在样品提取过程中,采用了用水浸泡的方式,让水分子充分浸透茶叶组织,而乙腈可以与水分子充分融合,有效提取茶叶中的蒽醌。QuEChERS提取方式常用于蔬菜、水果等植物源性食品的农药残留检验[3]。在用水浸泡茶叶的基础上,本实验采用该方法,能完全浸透样品,对待测物进行有效提取。QuEChERS盐包加入乙腈与水的混合溶液后,水相形成了过饱和溶液,会与乙腈自然分层,经高速离心后,上层溶液为含有蒽醌的乙腈溶液。
2.2 净化方式优化
茶叶的组分十分复杂,乙腈在提取待测组分蒽醌的同时,也会将大量的脂类、有机酸及色素等杂质溶解出来,如果不对提取液进行净化处理,直接上机会对仪器的离子源等造成极大的污染。因此,在上机前,清除提取液中的杂质是十分必要的。采用Sin-QuEChERS Nano茶叶专用净化柱,可以完全去除茶叶中的色素、有机酸等基质[4]。但是从上机结果来看,溶液中的蒽醌也会随着基质一同除去。因此,本实验采用了更为稳妥的分散固相萃取净化方式,以保证有效去除提取液中基质,而保留待测组分。
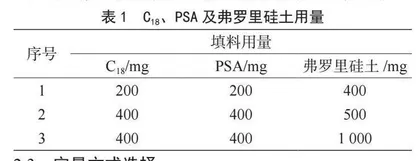
分散固相萃取过程中,常见的净化包填料包含无水硫酸镁(MgSO4)、疏水性链烷基化硅胶(C18)以及N-丙基乙二胺(Primary Secondary Amine,PSA)等,其中无水硫酸镁主要用来清除乙腈中的少量水分子,C18用于除去乙腈中的油脂类杂质,而PSA则用于吸附色素、金属离子及有机酸等。对于茶叶这种基质复杂、色素较多的样品来说,为了更好地消除基质对实验带来的影响,需要增加净化过程去清除提取液中的色素。用于清除色素类杂质最为常见的分散固相萃取填料为石墨化炭黑(Graphitized Carbon Black,GCB),但是在此实验中,石墨化炭黑对于茶叶中色素的清除效果有限,处理液的颜色依旧较深。本实验在使用无水硫酸镁、C18及PSA的基础上,向净化包中加入弗罗里硅土,获得了更好的净化效果。采用1 200 mg无水硫酸镁,不同含量的C18、PSA、弗罗里硅土(表1)对提取液进行分散固相萃取净化处理,结果表明,1 200 mg无水硫酸镁、400 mg C18、400 mg PSA、1 000 mg弗罗里硅土组成的净化包,对茶叶提取液的净化效果最好,净化液的颜色最浅,最大限度地去除了提取液中的杂质基质。
2.3 定量方式选择
在气相色谱-串联质谱法测定茶叶中蒽醌的检测方法中,有学者采用外标法定量的方法[5]。本实验尝试过采用外标法定量,但从上机结果来看,由3种茶叶经过前处理制得的基质标准溶液中,蒽醌的峰面积响应值有较大差距。考虑到茶叶种类的多样性,在上机过程中基质效应会对检测结果造成影响,因此本实验采用同位素内标法定量。同时,为了尽量降低上机液中基质对仪器的污染,提取液净化后进一步采用溶剂稀释的方法,以降低上机液中基质的含量。
2.4 方法学验证
2.4.1 方法的线性范围、定量限
对1.3项下配制的标准工作液进样分析,以蒽醌与蒽醌-D8同位素的峰面积比值为横坐标,以蒽醌的浓度为纵坐标,绘制标准工作曲线,得到标准曲线拟合方程为Y=1.033 938X+0.469 32,R2=0.996,蒽醌在0~200 ng·mL-1浓度范围内呈现良好的线性关系。
向2 g基质空白红茶样品中加入0.02 mL浓度为1 000 ng·mL-1的蒽醌标准中间液,按照样品前处理方法进行前处理,上机测定,信号与噪音的比值为17.35,通过计算得到本方法蒽醌的定量限为0.01 mg·kg-1。
2.4.2 加标回收率和精密度
分别取实验室检毕的空白样品,将红茶、绿茶及乌龙茶作为加标回收率的测试样品,每份样品称取2.00 g,分别加入3水平的蒽醌标准物质(每个水平进行6次平行实验),进行前处理并上机测定,结果见表2,其中回收率及相对标准偏差(Relative Standard Deviation,RSD)均满足《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)[6]的要求。
2.5 样品测试
使用该方法对实验室在检验品进行测试,所检样品中蒽醌检验结果均为<0.01 mg·kg-1,测定浓度在定量限以下。
3 结论
本文建立了QuEChERS提取、分散固相萃取净化,GC-MS/MS测定茶叶中蒽醌残留量的方法。该方法具有溶剂消耗少、回收率高、灵敏度高、稳定性好及操作简单、快速等特点,十分适用于实验室检验大批量、多种类茶叶中的蒽醌。
参考文献
[1]何华丽,樊继彩,任韧,等.杭州不同种类市售茶叶中9,10-蒽醌含量调查及膳食暴露研究[J].中国卫生检验杂志,2019,29(16):1998-2000.
[2]熊利华.近红外光谱法快速检测茶叶中粗纤维、水分和灰分的研究[D].南昌:东华理工大学,2018.
[3]蒋晓勤,袁荷,芳程妍,等.QuEChERS法萃取-气相色谱-三重四级杆串联质谱法快速测定果蔬中58种农药残留[J].分析仪器,2022(1):29-35.
[4]张权,毕珊,吴玉田,等.Sin-QuEChERS Nano净化柱结合气相色谱-串联质谱法快速筛查石斛中84种农药残留[J].色谱,2022,40(6):565-575.
[5]黄秋研,邱启东,陈卫强,等.固相萃取-气相色谱-质谱法测定茶叶中蒽醌残留[J].广东化工,2017,44(24):91-93.
[6]中国国家标准化管理委员会.实验室质量控制规范 食品理化检测:GB/T 27404—2008[S].北京:中国标准出版社,2008.