一株酸性果胶酶产生菌的筛选及酶学特性分析
作者: 符金铃 麻梦遥 蓝维申 曾莉清 孙嘉蔓 李帅Screening and Enzymatic Characterization Analysis of an Acid Pectinase-Producing Bacteria
FUJinling,MA Mengyao,LANWeishen, ZENGLiqing,SUNJiaman,LI Shuai* (School of Chemistry and Environmental Science, Xiangnan University, Chenzhou 423oo0, China)
Abstract: In this paper, a strain of pectinase-producing bacteria was screened from the soil by Congo red method,and the enzymaticcharacteristics ofthe pectinase produced by pectin were studied.The results showed that afilamentous fungus with pectinase-producing ability was screened from the soil,and it was identified as Aspergilus niger after molecular biological identification. Under the conditions of 50∘C and pH=4.0 , the pectinase enzyme activity produced by this bacterium was the best. When the pH value is 3.0 to 5.0, its stability is good.
Keywords: pectinase; Aspergillus niger; enzymatic properties
果胶酶来源丰富,植物、动物和微生物均具有果胶酶合成能力。研究发现,细菌、真菌中均有可产果胶酶的菌种,不同来源的果胶酶在酶学特性上表现出较大差异。果胶酶是能降解果胶物质的一类酶的总称[1],有酸性果胶酶和碱性果胶酶之分,这两类酶是重要的工业酶,它们在多个领域中有着广泛的应用。酸性果胶酶主要应用于食品行业,如蔬果汁的榨汁与澄清、酿酒、天然成分的提取[2-3]。
近年来,人们在工业生产中更加注重低成本、低污染、低耗能,生物酶制剂因具有用量少、专一性高、催化效率高、活性可调节性强以及天然环保等特点在工业应用中逐渐显现出优势。因此,本文从自然界中筛选出一株果胶酶产生菌,并探究其所产果胶酶的酶学特性,以期为果胶酶的生产和应用提供一定的理论基础。
1材料与方法
1.1材料与试剂
学院食堂周边的土壤果胶、半乳糖醛酸、刚果红、苯酚、酒石酸钾钠、亚硫酸钠、3,5-二硝基水杨酸、磷酸氢二钠、柠檬酸、氯化钾、氯化钙等,以上试剂均为分析纯。
1.2 仪器与设备
电子分析天平(AUY220),日本岛津公司;高压灭菌锅(SX-500),日本TOMY公司;超净工作台(CJ-10),天津市泰斯特仪器有限公司;分光光度计(A380),翱艺仪器(上海)有限公司;振荡培养箱(BSD-250),上海博迅实业有限公司。
1.3 培养基
筛选培养基:果胶 2.0g 、 K2HPO41.0g 、MgSO4⋅7H2O0.5g 、 NaNO33.0g 、 FeSO4⋅7H2O0.01g 琼脂粉 20.0g 、刚果红 0.4g 、蒸馏水 1.0L , pH=7.0 。
活化培养基:马铃薯 200.0g 、琼脂粉 15.0g 葡萄糖 20.0g 、蒸馏水 1.0L , pH 值自然。
发酵培养基:果胶 4.0g 、马铃薯 200.0g 、葡萄糖 20.0g 、蒸馏水 1.0L , pH 值自然
1.4 实验方法
1.4.1果胶酶产生菌的初筛
称取 5g 土壤样品于装有 50mL 无菌水的锥形瓶中, 30qC 下振荡 48h ,吸取土壤上清液得到菌悬液。采用浓度梯度稀释法稀释菌悬液,取稀释后的菌悬液 200μL 涂布于初筛培养基平板。 30qC 下培养 5~ 7d后,筛选出可产生水解圈的菌株,用于后续复筛。
1.4.2 果胶酶产生菌的复筛
将初筛得到的菌株接种于发酵培养基, 30°C 下振荡培养 72h ,取发酵液于4 C 、 5000r⋅min-1 离心 5min ,取上清液得到粗酶液。采用二硝基水杨酸(3,5-Dinitrosalicylicacid,DNS)法测定各菌株的果胶酶活力,选择酶活力最高的菌株作为目的菌株,用于后续的果胶酶酶学特性研究。
1.4.3 果胶酶活力的测定
果胶酶活力测定采用DNS法[4],步骤如下。
(1)半乳糖醛酸标准曲线的绘制。取14支比色管,按表1加入试剂,混匀后,沸水浴 10min ,立即用冷水冷却;待充分冷却后,加水定容至 25mL 以1号管为对照测 540nm 处的吸光度,绘制标准曲线。
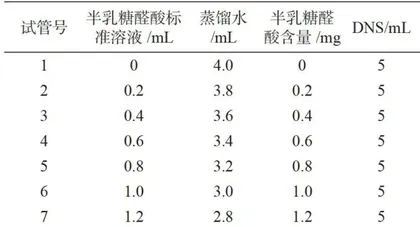
本文为全文原貌 未安装PDF浏览器用户请先下载安装
原版页码:shia20250627.pd原版全文
(2)果胶酶活力测定。取 4mL 缓冲液( pH=5.0 )、1mL 果胶底物、 1mL 经适当稀释的粗酶液于比色管中,以灭活的粗酶液为对照,摇匀后, 50qC 下反应30min. 。取 2mL 反应液于另一支比色管中,并加入2mL 蒸馏水、 5mL DNS试剂,沸水浴 10min ,用流动水冷却至室温后,加蒸馏水至 25mL ,摇匀,于3000r⋅min-1 离心 5min 。吸取上清,用分光光度计测 540nm 处的吸光度。
在一定条件下, 1mL 粗酶液每分钟水解果胶生成 1μg 半乳糖醛酸为一个酶活力单位( U⋅mL-1 )。酶活力的计算公式为
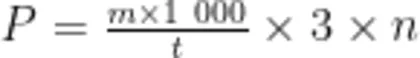
式中: P 为果胶酶活, U⋅mL-1 ; m 为根据标准曲线计算出的半乳糖醛酸质量, mg ; n 为粗酶液稀释倍数; t 为反应时间, min 。
1.4.4 菌株鉴定
待PDA培养基中的目的菌株长出白色菌丝后,将待测平板菌送至生工生物成都测序部进行ITS测序。采用BLAST工具对测序结果进行比对,并用MEGA11构建系统发育树。
1.4.5果胶酶的酶学特性研究
通过控制变量法,探究果胶酶的最适反应温度、pH 值,果胶酶的温度、pH值稳定性,以及金属离子对酶活的影响。
2 结果与分析
2.1果胶酶产生菌的初步筛选结果
根据1.4.1项方法进行果胶酶产生菌的初步筛选,共筛选出3株可产生明显水解圈的果胶酶产生菌,水解圈直径在 4.8~8.2mm 。详见表2。

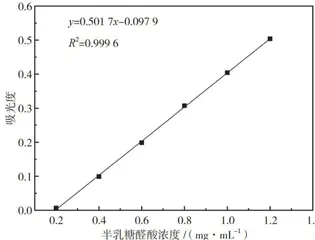
2.2半乳糖醛酸标准曲线
半乳糖醛酸标准曲线如图1所示。线性方程为y=0.501 7x-0.097 9 ,斜率 k 为0.5017, R2 为 0.9996 ,说明半乳糖醛酸浓度与吸光度之间具有较好的线性相关性,可用于酶活力计算。
2.3 果胶酶产生菌的复筛结果
根据1.4.3项方法测定3株果胶酶产生菌的酶活力,测得菌株A-1、A-2、A-3的酶活力分别为51.61,15.93,21.97UmL-1 。菌株A-1的酶活力最高,故选择该菌作为目的菌株,用于后续酶学特性研究。
2.4菌株鉴定结果
对目的菌株的ITS序列进行测序,测得该菌的ITS序列长度为 567bp 。使用NCBI中的BLAST工具进行ITS序列比对,结果显示目的菌株与Aspergillusnigerstrain GZ-4(KT726919.1) 的相似性为 100% 。采用邻接法构建系统发育树,结果如图2所示。可以看出,目的菌株A-1与AspergillusnigerstrainGZ-4(KT726919.1)处于发育树的同一支,表明目的菌株为黑曲霉(Aspergillusniger)
2.5果胶酶的酶学特性研究结果
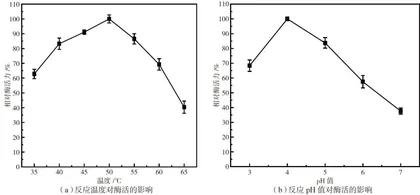
2.5.1 最适反应温度
如图3(a)所示,当反应温度为 35~50∘C 时,果胶酶酶活力呈上升趋势,且在 50qC 达到峰值;当温度高于 50qC 后,果胶酶的结构被破坏,相对酶活力开始下降,说明该果胶酶属于中温酶。
2.5.2 最适反应pH值
如图3(b)所示,当pH值为 3.0~4.0 时,相对酶活力逐渐上升,且在pH值为4.0时达到最大值;当pH值大于4.0时,相对酶活力呈下降趋势,说明该果胶酶属于酸性果胶酶。该果胶酶的最适反应pH值与文献报道的真菌所产果胶酶的最适反应pH值主要集中在 4.0~7.0 相符[5]。
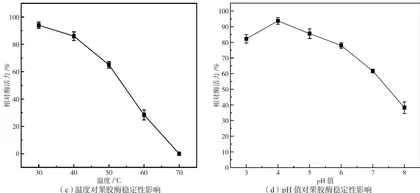
2.5.3 果胶酶的温度稳定性
如图3(c)所示,当粗酶液在30、 40°C 下处理1h时,酶活力可以维持在原始酶活力的 80% 以上;当处理温度升高至 70% 时,果胶酶已失去活性,说明该果胶酶在 30~40∘C 下稳定性较好,但不具有高温耐受性。

本文为全文原貌 未安装PDF浏览器用户请先下载安装
原版页码:shia20250627.pd原版全文