QuEChERS结合GC-MS/MS检测果蔬中13种农药残留
作者: 管益涛 陈明华 谷翠梅 马淑青
摘 要:目的:基于QuEChERS方法结合气相色谱串联质谱(Gas Chromatography-Tandem Mass Spectrometry,GC-MS/MS)技术,建立一种简单、快速检测果蔬中农药残留的方法。方法:果蔬样品匀浆后,先用乙腈和乙酸缓冲盐包提取,再用m-PFC小柱净化,最后用GC-MS/MS测定,外标法定量。结果:13种农药在10~500 μg·L-1浓度范围内线性关系良好,相关系数(R2)均大于0.994,检出限为0.35~0.92 μg·kg-1,定量限为1.0~2.8 μg·kg-1;13种农药在3个水平下的加标回收率为82.4%~110.1%,相对标准偏差为2.9%~9.3%。结论:所建立的方法可操作性强,具有较高的精密度和准确度,可用于果蔬中农药残留的定性和定量检测。
关键词:QuEChERS;气相色谱串联质谱法;农药残留;果蔬
Determination of 13 Pesticide Residues in Fruits and Vegetables by QuEChERS Combined with GC-MS/MS
GUAN Yitao, CHEN Minghua, GU Cuimei, MA Shuqing*
(Weifang City Center for Disease Control and Prevention, Weifang 261061, China)
Abstract: Objective: To establish a simple and rapid method for the detection of pesticide residues in fruits and vegetables based on the QuEChERS method combined with gas chromatography-tandem mass spectrometry (GC-MS/MS) technology. Method: After homogenization, the fruit and vegetable samples were first extracted with acetonitrile and acetic acid buffer, then cleaned up with m-PFC cartridges, and finally determined by GC-MS/MS and quantified by external standard method. Result: The 13 pesticides had good linear relationships in the concentration range of 10~500 μg·L-1, and the correlation coefficients (R2) were all greater than 0.994. The limits of detection were 0.35~0.92 μg·kg-1, and the limits of quantification were 1.0~2.8 μg·kg-1. The recoveries of the 13 pesticides at three levels were 82.4%~110.1%, and the relative standard deviation were 2.9%~9.3%. Conclusion: The established method is highly operable, has high precision and accuracy, and can be used for the qualitative and quantitative determination of pesticide residues in fruits and vegetables.
Keywords: QuEChERS; gas chromatography-tandem mass spectrometry; pesticide residues; fruits and vegetables
果蔬种植过程中不合理用药会导致农药残留,由于大部分果蔬是鲜食的,农药残留必然会增加果蔬的食品安全风险。因此,加强果蔬农药残留检验方法的研究非常有必要。目前,果蔬中农药残留检测的前处理方法主要有液-液萃取法、固相萃取法、固相微萃取法、QuEChERS法等[1-3]。农药残留的检验方法主要有气相色谱法(Gas Chromatography,GC)、液相色谱法(Liquid Chromatography,LC)、液相色谱串联质谱法(Liquid Chromatography-Tandem Mass Spectrometry,LC-MS/MS)、气相色谱串联质谱法(Gas Chromatography-Tandem Mass Spectrometry,GC-MS/MS)[4-5]等。QuEChERS前处理技术与色谱串联质谱技术相结合使果蔬中农药残留检测更加高效、便捷。
QuEChERS自2002年发布至今,经过不断的改进和完善,已发展成为一种适用性极强的多样化前处理技术[6-8]。快速滤过型净化柱(m-PFC)是基于QuEChERS方法研发的一种前处理净化柱,能够快速对样品进行前处理。它将填料装在注射器中,使用过程中通过抽提或推送的方式使提取液通过含有多壁碳纳米管(Multi-Walled Carbon Nanotubes,MWCNTs)、N-丙基乙二胺(Primary Secondary Amine,PSA)和无水硫酸镁的填料层,将色素、脂类、甾醇类等物质留在填料层,实现目标物与干扰物的分离,并去除样品中的水分[9-10]。本文基于QuEChERS前处理方法结合GC-MS/MS技术,通过优化前处理及上机分析条件,建立了一种快速滤过型净化法结合GC-MS/MS检测果蔬中13种常见农药残留的方法。
1 材料与方法
1.1 样品来源
实验所用果蔬从潍坊市各县(市、区)的超市、农贸市场、集市和路边摊位购买获得,主要为消费量较大的大白菜、菠菜、芹菜、黄瓜、香菜、西红柿、大葱、韭菜、苹果、梨、柑橘和樱桃等。
1.2 仪器与试剂
1.2.1 仪器
Thermo Trace1610/ TSQ9610三重四极杆气质联用仪(美国赛默飞),配备PAL3自动样品前处理平台(瑞士CTC公司);色谱柱为TG-5SILMS柱(30 m×0.25 mm,0.25 μm,美国赛默飞);LYNX4000高速冷冻落地离心机(美国赛默飞);Heidolph涡旋振荡器(德国海道夫);ARA520型电子天平(上海奥豪斯)。
1.2.2 试剂
13种农药标准品:丙酮中灭线磷、丙酮中水胺硫磷、丙酮中三唑磷、丙酮中毒死蜱、正己烷中α-硫丹、正己烷中β-硫丹、正己烷中五氯硝基苯、正己烷中百菌清、正己烷中硫丹硫酸盐、正己烷中三氟氯氰菊酯(氯氟氰菊酯)、正己烷中杀螨酯、丙酮中速克灵(腐霉利)和丙酮中噁霜灵,浓度均为100 μg·mL-1,均购自农业农村部环境保护科研监测所。
色谱纯乙腈、丙酮、乙酸乙酯,购自美国赛默飞;普通盐包(1 g氯化钠和4 g无水硫酸镁)、柠檬酸缓冲盐体系盐包(1 g氯化钠、4 g无水硫酸镁、1 g柠檬酸钠和0.5 g柠檬酸氢二钠)、QuEChERS净化管A(900 mg无水硫酸镁和150 mgPSA)和QuEChERS净化管B(900 mg无水硫酸镁、150 mg PSA和15 mg GCB),购自美国Thermo公司;乙酸缓冲盐体系盐包(6 g无水硫酸镁和1.5 g醋酸钠)、m-PFC小柱A(简单基质,包括150 mg无水硫酸镁、15 mg PSA和15 mg MWCNTs)、m-PFC小柱B(复杂基质,包括150 mg无水硫酸镁、15 mg PSA和25 mg MWCNTs)和陶瓷均质子,购自北京绿绵科技有限公司;0.22 μm有机滤膜,购自天津艾杰尔公司。
1.3 样品的前处理
1.3.1 提取
准确称取10 g样品,匀浆后(果蔬样本尽量不要用水清洗)置于50 mL塑料离心管,加入10 mL乙腈后剧烈振荡1 min,然后加入1包通用盐包或缓冲盐包,加入1颗陶瓷均质子,盖上离心管盖,剧烈振荡1 min后4 200 r·min-1离心5 min。
1.3.2 净化
净化离心管:吸取6 mL上清液至净化离心管中,涡旋混匀1 min后4 200 r·min-1离心5 min,吸取上清液,过0.22 μm有机滤膜,用进样小瓶承接流出液,待GC-MS/MS进样分析。
m-PFC小柱:吸取2 mL上清液,移入m-PFC小柱上端,缓慢推动注射杆,收集首次滤过液,重新移入原净化小柱,按照相同的滤过速度重新滤过,柱底端连接0.22 μm有机滤膜,滤膜下方连接进样小瓶,收集二次滤液,待GC-MS/MS进样分析。
1.4 标准溶液的配制
用玻璃吸管将13种标准溶液全量(1.0 mL)转移至25 mL容量瓶中,用乙腈稀释至刻度,摇匀,配成浓度为4.0 μg·mL-1的中间液。使用空白蔬菜、水果基质液将中间液稀释成浓度为10 μg·L-1、20 μg·L-1、50 μg·L-1、100 μg·L-1、200 μg·L-1和500 μg·L-1的系列标准溶液。
1.5 仪器分析条件
1.5.1 色谱条件
TG-5SILMS色谱柱(30 m×0.25 mm,0.25 μm);不分流进样,进样量:1 μL;载气:高纯氮(浓度≥99.999%),恒流方式,流速1.0 mL·min-1;碰撞气:高纯氩(浓度≥99.999%);程序升温:初始温度60 ℃,保持1.0 min后以40 ℃·min-1速度升至120 ℃,再以10 ℃·min-1速度升至310 ℃,保持5.0 min至待测组分全部流出;进样口温度:280 ℃。
1.5.2 质谱条件
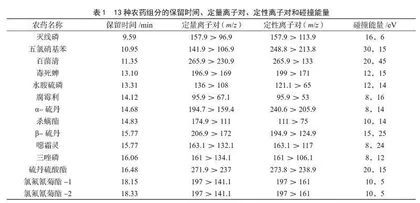
离子源为电子轰击源,温度为330 ℃,能量为70 eV;质谱传输线温度为280 ℃;发射电流:50 A。采用Full Scan模式确定每种组分的保留时间及最强离子碎片,再采用SRM采集模式测定,每种农药分别选择1个定量离子对和1个定性离子对,按照出峰顺序分时分别检测离子对。13种农药的保留时间、定量离子对、定性离子对和碰撞电压见表1。
2 结果与分析
2.1 前处理条件的优化
2.1.1 提取条件的选择
本实验以在黄瓜和苹果基质中添加100 μg·kg-1混合标准溶液的回收率为考察指标,比较了3种萃取盐包的提取效果。以乙腈为提取溶剂,普通盐包的加标回收率为61.2%~114.3%,相对标准偏差为9.8%~21.5%;柠檬酸缓冲盐包的加标回收率为76.4%~117.1%,乙酸缓冲盐包的加标回收率为75.7%~119.1%,两种缓冲盐包相对标准偏差均小于12%。缓冲盐包的提取效果优于普通盐包,两种缓冲盐包回收率无明显差异,后续实验采用乙酸缓冲盐包提取。
2.1.2 净化条件的选择
本实验比较了2种QuEChERs净化管和2种m-PFC小柱的净化效果。果蔬提取液,用净化管A净化后的回收率为67.2%~113.3%,样品颜色深;用净化管B净化后的回收率为63.4%~112.1%,样品颜色较浅;用m-PFC小柱A净化后的回收率为75.4%~116.3%,样品颜色较浅;用m-PFC小柱B净化后的回收率为74.7%~117.1%,样品颜色浅。结果显示,m-PFC小柱B去除色素效果最好,m-PFC小柱A和净化管B效果次之,净化管A效果最差;m-PFC小柱的加标回收率高于QuEChERs净化管,两种m-PFC小柱的加标回收率相差不大。因此,可选择m-PFC小柱对果蔬提取液进行净化,一般果蔬选择m-PFC小柱A,色素严重的复杂基质样品选择m-PFC小柱B。本实验选择m-PFC小柱A净化。