固相萃取-同位素稀释液相色谱-串联质谱法测定橄榄油中4种交链孢霉毒素含量及其分布状况
作者: 蔡琛 程先先 吴学森
摘 要:目的:建立固相萃取-同位素稀释液相色谱-串联质谱法测定橄榄油中4种交链孢霉毒素含量的方法并描述其在橄榄油中的分布状况。方法:将橄榄油混匀后取5 g(精确至0.001 g),经乙腈-磷酸二氢钠溶液混合溶液提取,固相萃取柱净化,收集净化液经水浴氮吹浓缩后,采用超高效液相色谱质谱仪测定,内标法定量。结果:交链孢菌酮酸(tenuazonic acid,TeA)在0~50 ng/mL、交链孢酚(alternariol,AOH)在0~20 ng/mL、腾毒素(tentoxin,TEN)在0~10 ng/mL、交链孢酚单甲醚(alternariol methyl ether,AME)在0~2 ng/mL范围内线性良好(R>0.99)。TeA 、AOH 、TEN、AME的检出限在0.20~2.00 μg/kg 范围之间。4种生物毒素加标回收率为92.25%~124.66%,精密度范围3.79%~10.58%,表明本方法样本检测量小、灵敏度高、准确度高、精密度高,重现性好,是检测橄榄油中交链孢霉毒素的理想方法。结论:橄榄油普遍受到交链孢霉毒素污染,检出率93.33%(28/30),AME毒素是橄榄油中最主要的检出毒素。
关键词:固相萃取-同位素稀释液相色谱-串联质谱法;交链孢霉毒素;橄榄油
交链孢霉在自然界中分布范围极其广泛,对一些植物不仅具有腐生性,还具有致病性[1]。低温条件下交链孢霉菌能够正常生长繁殖,因此在冷链储藏和运输过程中食品也会存在腐败和变质[2]。该菌能产生多种有毒代谢产物,对人畜具有致癌作用并影响人畜健康。有研究表明,摄入被交链孢毒素污染的食品可能造成我国某些地区食管癌高发[3]。因此,食品中交链孢毒素的污染情况已成为重要的危害人体健康的公共卫生问题。橄榄油含有较高水平的单不饱和脂肪酸,研究表明,食用单不饱和脂肪酸有降低血糖[4]、调节血脂[5]、降低胆固醇[6]等功效,越来越多居民选择橄榄油。2019—2020年,我国已成为橄榄油进口量增长的第二大市场,我国将成为未来世界第一大橄榄油消费国[7]。本研究就固相萃取-同位素稀释液相色谱-串联质谱法测定橄榄油中4种交链孢霉毒素含量及其分布状况进行分析。
1 食品污染中最常见的交链孢毒素
污染食品的交链孢霉种类多种多样,其产生的交链孢毒素主要包括交链孢菌酮酸(TeA) 、交链孢酚(AOH)、腾毒素(TEN)、交链孢酚单甲醚(AME) 4类毒素[8]。
2 交链孢毒素的毒性
大多数交链孢毒素对人体造成的急性毒性程度较低。但有研究表明,AOH、AME对细胞产生遗传毒性[9]和导致细胞突变[10]。FehR等[11]研究认为,AOH和AME在微摩尔浓度下显著增加了人类癌细胞(HT29,A431)的DNA链断裂率,其中AOH有效地抑制了DNA的松弛,并刺激了拓扑异构酶I、IIα和IIβ的DNA裂解活性从而引起细胞 DNA损伤。YEKELER等[12]研究认为,AME和TeA对小鼠食道可能产生毒性影响。实验表明,每天给小鼠喂食AME或TeA,持续10个月后,通过光镜检查,在TeA处理的动物中观察到中度和严重的发育不良,其特征是极性丧失、核多形性和超色性,表现为食管粘膜出现癌前病变。Lehmann等[13]用AOH 处理V79细胞,发现细胞分裂周期停滞在G2和S期。Wollenhaupt等[14]研究发现,AOH对猪子宫内膜细胞的生存能力有影响。在用 AOH处理后,S期的细胞明显减少,而G(0)/G(1)期的细胞停滞,因此认为AOH在翻译水平上影响基因的表达。Liu等[15]发现,AME和AOH可与从人胎儿食道上皮细胞中分离出的DNA结合,激活其中的致癌物质c-H-ras和c-mys,并在体外促进人胎儿食道上皮细胞的增殖,其次在食道癌高发区林县的粮食中分离出来的主要污染性真菌为AOH和AME,因此认为进食被交链孢毒素污染的食品可能与中国某些地区食管癌高发有关。
3 材料与方法
3.1 材料与试剂
3.1.1 材料 包装橄榄油,市场购买。
3.1.2 试剂 细交链格孢菌酮酸(TeA,纯度>99%)、链格孢酚(AOH,纯度>99%)、腾毒素(TEN,纯度>99%)和交链格孢酚单甲醚(AME,纯度>99%)标准品,均购于美国 ROMER 公司;同位素内标:细交链格孢菌酮酸-D13(TeA-D13,纯度>99%)、链格孢酚-D2(AOH-D2,纯度>99%)、腾毒素-D3(TEN-D3,纯度>99%)、交链格孢酚单甲醚-D3(AME-D3,纯度>99%)、标准品,均购于加拿大 TRC 公司;乙腈(色谱纯)、甲醇(色谱纯),购于美国Thermor Fisher公司;无水磷酸二氢钠(色谱纯),购于天津科密欧化学试剂有限公司;碳酸氢铵(色谱纯),上海罗恩化学试剂有限公司;磷酸(分析纯),国药集团化学试剂有限公司;0.05 mol/L磷酸二氢钠溶液(pH 3.0):称取6.0 g无水磷酸二氢钠,溶解于950 mL水中,用磷酸调节pH 3.0,用水定容至1 000 mL,混匀;固相萃取柱(Waters Oasis HLB 200 mg/6cc);样品提取液:取550 mL乙腈,加到450 mL 0.05 mol/L磷酸二氢钠溶液(pH 3.0)中,混匀;水(符合GB/T 6682规定的一级水)。
3.2 仪器与设备
Thermo Fisher 超高效液相色谱-串联质谱仪,美国ThermoFisher公司,配有Hypersil Gold VANQUISH C18 色谱柱(1.9 μm,2.1 mm×100 mm);超声波清洗器,上海科器仪器设备有限公司;多管涡旋混匀仪,上海净信实业发展有限公司;离心机,美国ThermoFisher公司;1/千电子天平,瑞士Mettle公司;50 mL塑料离心管,浙江拱东医疗器械股份有限公司;Milli-QA10 超纯水器,美国 Millipore公司;固相萃取仪,上海力辰邦西仪器科技有限公司;氮吹仪,上海乔跃电子有限公司;移液器(1~10、10~100、100~1 000 μL),德国eppendorf公司。
3.3 方法
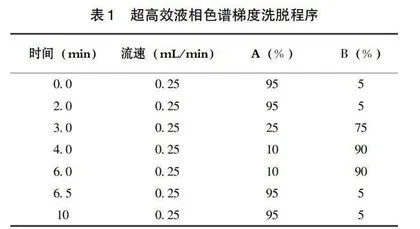
3.3.1 超高效液相色谱条件 色谱柱型号:Hypersil Gold VANQUISH C18液相色谱柱(100 mm×2.1 mm,1.9 μm);柱温条件:40℃;流动相配比:A(1.0 mmol/L碳酸氢铵溶液)+B(甲醇),采用梯度洗脱;梯度洗脱程序见表1;进样量:2 μL;流速:0.25 mL/min。
3.3.2 超高效液相色谱-串联质谱条件 离子化模式:采用电喷雾离子源(ESI);电离方式:负离子模式;质谱扫描方式:多反应监测(MRM);电离电压:3 500V;离子源温度:350℃;鞘气流量:35 Arb;碰撞气流量:10 Arb;反吹气流量:1 Arb。4种链格孢霉毒素及同位素内标物的保留时间、监测离子、锥孔电压和碰撞电压质谱参数如表2所示。
3.3.3 标准溶液的配制
(1)同位素内标储备液:分别准确称取4种交链孢霉毒素内标标准品,用乙腈溶解并定容,混匀,得到TeA-D13储备液(100 μg/mL)、AOH-D2储备液(100 μg/mL)、TEN-D3储备液(100 μg/mL)、AME-D3储备液(100 μg/mL),密封后置于-20℃避光保存。(2)标准储备液:分别准确称取适量4种链格孢霉毒素标准品,用甲醇溶解并定容,混匀,得到TeA标准储备液(100 μg/mL)、AOH标准储备液(100μg/mL)、TEN标准储备液(100 μg/mL)、AME标准储备液(100 μg/mL),密封后置于-20℃避光保存。(3)混合标准工作液(TeA:500 ng/mL,AOH:200 ng/mL,TEN:100 ng/mL,AME:20 ng/mL):分别准确移取50 μLTeA标准储备液(100 μg/mL)、20 μLAOH储备液(100 μg/mL)、10 μLTEN储备液(100 μg/mL)、2 μLAME储备液(100 μg/mL)至10 mL容量瓶中,用甲醇定容至刻度,混匀,密封后置于4℃避光保存。(4)混合内标工作液(TeA-D13:500 ng/mL,AOH-D2:200 ng/mL,TEN:100 ng/mL,AME:20 ng/mL):分别准确移取50 μLTeA-D13标准储备液(100 μg/mL)、20 μLAOH-D2储备液(100 μg/mL)、10 μLTEN-D3储备液(100 μg/mL)、2 μLAME-D3储备液(100 μg/mL)至10 mL容量瓶中,用甲醇定容至刻度,混匀,密封后置于-20℃避光保存。(5)标准曲线绘制:取适量混合标准工作液和混合内标工作液,用甲醇和水配置成标准系列,具体配置信息见下表3。将标准系列溶液注入超高效液相色谱串联质谱仪,得到4种交链孢霉菌毒素的色谱图和峰面积。分别以TeA、AOH、TEN、AME的浓度为横坐标,以TeA、AOH、TEN、AME的峰面积与各自内标峰面积之比为纵坐标,绘制TeA、AOH、TEN、AME标准曲线图。
3.3.4 样品前处理方法 (1)提取:橄榄油置于常温避光保存,称样前需充分混匀。然后称取橄榄油5 g(精确至0.001 g)于50 mL刻度离心管中,加入100 μL混合内标工作液,涡旋混匀10 s,静置过夜。样品中加入25 mL样品提取液,旋紧盖子,涡旋混匀10 s,高速涡旋振荡器震荡提取20 min,于4℃,10 000 r/min离心10 min,室温静置2 h,待溶液明显分层且上清液无细小油粒后,移取5 mL上清液,加入15 mL 0.05 mol/L磷酸二氢钠溶液(pH 3.0),混匀,10 000 r/min离心10 min,上清液待净化。(2)净化:HLB固相萃取柱依次用5 mL甲醇和5 mL水活化。将稀释后的上清液(20 mL)全部过柱,再用5 mL 20%甲醇溶液淋洗,于负压状态下抽干柱子5 min。将小试管放于固相萃取柱下,依次用5 mL甲醇和5 mL乙腈洗脱,收集洗脱液于小试管中,45℃水浴氮吹近干,残渣先用200 μL甲醇复溶,涡旋混匀10 s,再加1.8 mL水,涡旋混匀10 s。4℃,10 000 r/min下离心5 min,取上清液过0.22 μm有机滤膜,滤液经LC-MS/MS进行检测。
4 结果与分析
4.1 线性关系和检出限
在优化的高效液相色谱、质谱和前处理条件下对空白基质的标准系列进行检测。表4结果表明,4种交链孢霉毒素在一定浓度范围内均具有良好的线性关系,R>0.99。在信噪比为3 时,TeA 、AOH 、TEN、AME的检出限在0.20~2.00 μg/kg 范围之间。
4.2 加标回收率
30份样本中随机选择3份样本,分别取其平行样,在每份样本平行样中分别加入50 ngTeA、20 ngAOH、10 ngTEN、2 ngAME,与该样本进行相同处理后经超高效液相色谱串联质谱仪测定,计算得出回收率范围92.25%~124.66%,精密度范围3.79%~10.58%(表5)。
4.3 橄榄油中4种交链孢霉菌毒素污染水平含量分析
本次橄榄油样本量30份,每份样本平行检测6次取平均值。4种交链孢霉菌毒素在30份橄榄油中有不同浓度水平的检出,总检出率93.33%,总含量范围0.631~4.261 μg/kg。AME检出率最高93.33%,含量范围0.631~9.098,最大浓度9.722 μg/kg,平均浓度2.361 μg/kg;AOH检出率20.00%,含量范围2.760~4.261,最大浓度4.261 μg/kg,平均浓度3.351 μg/kg;TEN检出率10.00%,含量范围0.705~1.288,最大浓度1.288 μg/kg,平均浓度0.959 μg/kg;TeA在30份样本中未检出,检出率0.00%(表6)。
4.4 橄榄油中4种交链孢霉菌毒素叠加检出分析