煮制对多花黄精多糖结构及其体外免疫刺激活性的影响
作者: 吴兰兰 吴钢 谭强来 林锦峰 甘淑娇 熊梅惠 吴伟菁
摘要:目的:煮制是多花黄精加工最常用的方法之一。探讨不同煮制温度及时间对多花黄精多糖构效关系的影响,为其在加工中高效利用和精准控制提供参考。方法:通过不同煮制条件获得的多花黄精多糖,采用FT-IR、离子交换色谱、GPC-MALLS等方法分析多糖官能团、单糖组成、分子量及分布等结构信息。结合小鼠巨噬细胞模型,评价不同煮制条件对黄精多糖促进免疫刺激活性的影响,包括细胞活力、一氧化氮分泌量。结果:煮制温度的升高及时间延长可促使黄精多糖中的阿拉伯糖、半乳糖、半乳糖醛酸质量比升高,葡萄糖、木糖质量比降低;多花黄精有2个多糖峰;中低温度煮制条件下,多糖分子量随煮制时间的增加而降低。然而,高温煮制下可触发黄精多糖先发生聚集后再降解。RAW 264.7巨噬细胞一氧化氮分泌量结果表明,温度升高及延长煮制时间可破坏多花黄精多糖的免疫刺激活性。结论:煮制温度和时间改变多花黄精的结构并影响其免疫活性,因此在实际加工中,应避免过度加工,以防降低黄精功效。
关键词:多花黄精;多糖;煮制;结构;免疫活性
多花黄精为百合科黄精属草本植物[1],是中国特色的药食同源类食品,其根茎具有良好的保健功能[2]。黄精食用前需经热处理去除对舌头及喉咙的刺激性。据文献记载,黄精加工主要有蒸、煮、“九蒸九制”等方式[3-6]。经典加工方法是将黄精与黄酒拌匀后,共同蒸制,实则为煮制。药典中提到煮制要点为炖透;且蒸、煮在一定程度上能够降低黄精的毒性,提升其效用[6-8]。
多糖是多花黄精的核心功能组分,也是其质量评价的关键指标[9-11]。已有研究发现,蒸制可使得多糖含量减少近一半[6, 12-13]。蒸制温度通常为100 ℃,因此,通过降低温度,可能有利于降低热加工对多糖含量的破坏,但现有研究多依照古法进行蒸制,鲜有探究温度对黄精多糖的影响。且多糖提取多采用热水浸提,类似于煮制,现有研究主要集中在煮制时间对多糖含量的影响[14-16]。与其他多糖不同,黄精多糖经热处理,尤其是100 ℃蒸制过程中多糖含量呈现下降趋势。可见,黄精多糖对加工温度和时间更加敏感,有必要探究温度及时间对于黄精多糖的影响[17]。
研究发现,生、熟黄精的多糖含量、分子量及单糖组成均有变化,说明在黄精加工过程中,多糖含量降低,多糖结构发生变化,同时多糖生理活性的变化,如抗氧化、降血糖等[18],进而影响多花黄精的营养价值。但是鲜有研究加工过程中,黄精多糖结构变化对免疫刺激活性的影响。根据现有文献,黄精多糖结构在蒸制过程中虽然多糖含量显著下降,但是分子量增加,说明黄精多糖可能发生聚合[18],然而其触发黄精多糖降解及聚合的温度和时间,尚不清楚。因此,基于优化黄精加工及其多糖的提取工艺,本研究通过不同温度及时间煮制多花黄精,随后分离多花黄精多糖。测定并分析黄精多糖的分子量、单糖组成等分子结构的变化。同时,基于RAW264.7巨噬细胞模型,分析煮制温度及时间对黄精多糖免疫刺激活性的影响,以期为多花黄精多糖在加工中高效利用和精准控制提供参考。
1材料与方法
1.1材料与试剂
多花黄精根茎(野生),采自福建省邵武市,由邵武市山乘山生态农业开发有限公司提供;RAW 264.7细胞,中科院细胞库(上海);DMEM培养基及胎牛血清,上海Sigma公司;细胞计数试剂盒-8(CCK-8)、脂多糖(LPS),兰杰柯科技有限公司;NO试剂盒,碧云天生物技术有限公司。其他试剂均为分析纯。
1.2仪器与设备
电子天平(BSA224S),塞多利斯科学仪器北京有限公司;磁力搅拌器(JK-DMS),上海精学科学仪器有限公司;多功能酶标仪(Infinite M1000),奥地利Tecan公司;水浴锅(HWS-24),上海一恒科学仪器有限公司;分析天平(SECURA),塞多利斯科学仪器北京有限公司;傅里叶红外光谱仪(Alpha),德国布鲁克公司;离子交换色谱(ICS-3000),DIONEX, USA;液相色谱,Waters科技有限公司;多角度激光散射(DAWN EOS),美国怀雅特技术公司;示差检测器(OPTILAB DSP),美国怀雅特技术公司。
1.3方法
1.3.1多花黄精多糖的制备将多花黄精去须、洗净后切片,厚度约3 mm。置于50 ℃烘箱过夜后研磨成粉。取多花黄精粉末10 g,以料液比1:20(w/v)进行搅拌,温度梯度分别设置为60、80、100 ℃,在同一个温度度下,分别搅拌煮制2、6、12 h。获得的9种多糖溶液于10 000 r/min离心10 min,上清液加入4倍无水乙醇静置过夜,随后离心(5 000 r/min,2 min)收集沉淀,加水复溶后,冷冻干燥[19],即得到不同煮制处理的多花黄精多糖。
1.3.2傅里叶变换红外光谱检测(FT-IR)取多花多糖样品与干燥的溴化钾研磨混合(1:200,w/w),压制成片。红外光谱扫描范围为400 ~4 000 cm-1[20-21]。
1.3.3多糖分子量的测定多黄黄精多糖采用MALLS-GPC测定其分子参数[22]。配制浓度为0.5 mg/mL的黄精多糖,充分混匀后,使用0.22 μm滤膜过滤,再利用配备有Wyatt多角度光激光散射和示差检测器的高效凝胶渗透色谱测定其分子量和平均分子量分布。流动相为0.1 mol/L硝酸钠,流速0.5 mL/min,dN/dC值为0.15。数据采用Astra软件进行分析。
1.3.4单糖组成的测定采用4 mol/L三氟乙酸溶液于120 ℃反应2 h,随后氮吹挥干液体。样品溶于10 mL的纯净水中,过0.22 μm膜后,上样10 μL。离子交换色谱仪配备脉冲安培检测器,色谱柱:Carbo PacTM PA20(3×150 mm)连接Carbo PacTM PA20 BioLCTM保护柱(3×30 mm)。流动相:超纯水(A)、250 mmol/L氢氧化钠溶液(B)、1 mol/L 醋酸钠溶液(C),流速1 mL/min [23]。具体梯度洗脱条件:0~20 min,流动相A:B:C为91:9:0;20~20.1 min,流动相A:B:C为86:9:5;20.1~40 min,流动相A:B:C为71:9:20;40~40.1 min,流动相A:B:C为0:100:0。
1.3.5小鼠巨噬细胞RAW 264.7的培养小鼠巨噬细胞RAW 264.7加入DMEM高糖培养基(含10%的胎牛血清、1%的双抗),置于37 °C、5%CO2的培养箱中培养。每天观察细胞生长状况,并及时更换新鲜培养基[24]。
1.3.6巨噬细胞活力的测定多花黄精多糖充分溶解在DMEM完全培养基中,配置成1 mg/mL的多糖母液。采用0.22 μm的无菌微孔滤膜过滤,随后加入适量DMEM完全培养基将其稀释成不同浓度梯度。多花黄精多糖对于巨噬细胞存活率的影响采用CCK-8法测定[25]。巨噬细胞计数后,以2×104个/孔,按照100 μL/孔播种于96孔细胞板中,过夜培养。随后,分别加入9种黄精多糖溶液100 μL,使其终浓度分别为6.25、25、100 μg/mL。空白对照组及阳性对照组分别加入100 μL的DMEM完全培养基及脂多糖(LPS,终浓度为2 μg/mL)。继续培养24 h后,小心弃去上清液,加入100 μL含有CCK-8的新鲜培养基,继续培养2 h。培养结束后于405 nm测定吸光值。每个样品设6个复孔。
1.3.7一氧化氮(NO)释放量的测定细胞播种及样品反应同1.3.6。样品培养结束后,取上清液,采用Griess法测定上清液中NO含量[26]。每个样品设6个复孔。
1.3.8数据分析数据使用SPSS 23.0软件行统计学处理。结果以平均值±标准差(SD)表示,采用One-way ANOVA方差分析,事后比较采用邓肯分析,P<0.05为具有统计学差异。
2结果与分析
2.1多花黄精多糖傅里叶变换红外光谱(FT-IR)
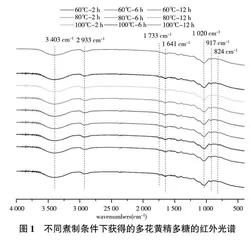
由图1可知,采用不同煮制温度和时间,黄精多糖官能团的伸缩及振动区间及幅度未发生明显变化,同时存在多糖特征吸收峰。根据文献可知,3 403 cm-1、2 933 cm-1、1 733 cm-1、1 641 cm-1吸收谱带分别是由-OH、C-H、C=O的伸缩振动引起[27-29];1 020 cm-1处吸收峰为吡喃环结构引起[30];917 cm-1、824 cm-1处吸收峰表明黄精多糖具有α-糖苷键和β-糖苷键[31]。图1结果表明,煮制加工工序未对黄精多糖的一级结构产生影响。
2.2煮制对多花黄精多糖单糖组成的影响
由图2可以看出,不同煮制条件下获得的多花黄精多糖的单糖组成主要有阿拉伯糖、半乳糖、葡萄糖、木糖和半乳糖醛酸。煮制条件对多糖单糖组成的改变取决于煮制温度。低温煮制条件下(60 ℃),随着时间延长,单糖组成变化较小。但温度提高,单糖组成产生较大变化。60 ℃煮制2 h的黄精多糖中,葡萄糖质量比低于木糖质量比,然而高温煮制(80 ℃及100 ℃)2 h,图1不同煮制条件下获得的多花黄精多糖的红外光谱
葡萄糖质量比则高于木糖质量比。中高温度均可促使阿拉伯糖、半乳糖含量升高,葡萄糖、木糖降低。但高温促使这几类单糖组分变化的速率显著高于中温。且在100 ℃下,12 h的长时间煮制,使得黄精单糖组成由葡萄糖(占44.01%)、木糖(占37.99 %)为主,转变为半乳糖(占31.85%)、木糖(占30.71%)、葡萄糖(占29.10%)为主。另外,阿拉伯糖由2.26%提高至6.48%,半乳糖醛酸含量也显著提高。
通常情况下提高温度,有利于提高多糖的得率,但是不同于其他植物多糖,黄精多糖结构易受加工温度的影响。温度高于80 ℃,黄精多糖的单糖组成则随着煮制时间延长发生变化,尤其超过100 ℃,黄精多糖单糖组成变化速率增加,而黄精现有加工方式多为100 ℃,且加工时间多超过12 h。另有研究指出,不同温度及时间下提取的多花黄精多糖的单糖组成不同[28-29, 32]。因此,不同煮制温度与时间造成黄精多糖单糖组成的改变,可能是影响其生理活性的关键因素之一。已有研究报道,多花黄精多糖富含果糖[28-29]。红外光谱分析表明,多花黄精多糖中含有果糖。然而,本研究在预处理过程中通过强酸水解果糖,使其转化为甘露糖和葡萄糖[33]。因此,本研究的单糖成分中没有检测到果糖。
2.3煮制对多花黄精多糖的分子量的影响
附表为不同煮制温度和时间下,多花黄精多糖的分子参数:重均分子量(Mw)、数均分子量(Mn)、分子量分布Mw/Mn及均方根半径(Rz)[34-35]。通过MALLS-GPC分析可知,经过煮制后的多花黄精中的多糖存在2个峰。其中峰1为多花黄精多糖中高分子量组分(分子量Mw范围为2.246×105~7.476×105)。相同煮制时间下,高温煮制的黄精多糖分子量均高于低温煮制的黄精多糖。60 ℃和80 ℃的多糖Mw值随着煮制时间延长而降低,12 h后分别降低26.1%和24.8%,但其Mw/Mn值均大于3,表明通过煮制后的多糖发生降解,产生不均一聚合物。然而,在100 ℃条件下,随着煮制时间延长Mw值先升后降。煮制6 h的黄精多糖的Mw值较2 h煮制增加67.8%。虽然煮制12 h后Mw比煮制6 h小,但大于2 h煮制后的多糖Mw。Mw/Mn值由5.656降至1.897,表明随着温度升高及时间的推移,多糖分子量分布变窄,即在100℃条件下,黄精多糖可能先聚集后随着时间延长发生降解。峰2多花黄精多糖中为低分子量组分(分子量Mw范围为6.110×103~9.851×103)。60 ℃和80 ℃长时间煮制(12 h)条件下的多糖Mw值低于煮制2 h后的黄精多糖的分子量。100 ℃多糖Mw值随着煮制时间延长呈先上升后下降。但12 h煮制下的多糖Mw仍然高于煮制2 h。3个温度下煮制不同时间的Mw/Mn值均大于1.2,与峰1相比,小分子量的聚合物分子量分布较窄,聚合物均一性较峰1好。试验结果表明,100 ℃高温煮制条件下,黄精多糖可产生聚集形成更大分子量的黄精多糖,而相对中低温条件下,则无此现象。随着时间延长,黄精多糖逐渐降解。因此,煮制的温度和时间均可影响黄精多糖聚集及降解。