叶酸营养状况与宫颈癌发生及病理特征的相关性分析
作者: 张雅莉 刘向娇 张莉 毕胜利
摘 要:目的:探讨叶酸营养状况与宫颈癌发生及术后病理特征的相关性。方法:回顾性收集自2020年2月—2022年9月在本院妇科就诊的81例宫颈癌患者和86例健康体检女性为研究对象。采用健康问卷收集患者年龄、初次性生活年龄、经阴道分娩史、孕次、吸烟、饮酒等一般情况资料,患者住院病历及体检报告收集2组研究对象高危型人乳头瘤病毒(HPV)感染情况,以及宫颈癌患者术后病理信息。收集2组研究对象清晨空腹静脉血检测血清叶酸水平。叶酸营养状况与宫颈癌发生的相关性采用 Spearson相关,多因素分析采用Logistic多元回归。结果:与对照组相比,宫颈癌组患者年龄大,初次性生活年龄<23岁、孕次>2次以及高危型HPV感染者的人数多,差异均有统计学意义(P<0.05)。宫颈癌组患者血清平均叶酸水平低于对照组[(6.03±1.87) vs(4.76±1.49)ng/mL,P=0.011],宫颈癌患者血清叶酸水平≤3.1 ng/mL人数高于对照组[(19/62) vs (5/81),P=0.009],且血清叶酸水平与宫颈癌的发生呈显著负相关(r=-0.518,P<0.05)。年龄、初次性生活年龄≥23岁、感染高危型HPV及叶酸水平≤3.1 ng/mL是宫颈癌发生的危险因素,均有OR>1、P<0.05。宫颈癌患者血清叶酸水平≤3.1 ng/mL与淋巴结转移(r=-0.437)、临床分期相关(r=-0.408),均有P<0.05。结论:叶酸营养状况与宫颈癌的发生及术后较差的病理特征呈负相关,且血清叶酸水平≤3.1 ng/mL是发生宫颈癌的危险因素。女性应关注叶酸营养状况,注意叶酸补充,以预防宫颈癌的发生发展。
关键词:叶酸;宫颈癌;病理特征;危险因素
宫颈癌是常见的妇科肿瘤之一,发病率约占女性恶性肿瘤的第四位,而全球约1/3的患者发生在我国,且我国死亡率也高于众多发达国家,严重威胁着我国女性的生命健康[1-2]。参与宫颈癌发生发展的因素众多,高危型人乳头瘤病毒(HPV)的持续感染已被证实与宫颈癌相关[3-4],除此之外,过早性生活、多产、吸烟等因素也可能是宫颈癌发生发展的诱发因素[5-6],但确切的危险因素尚未十分确定。近年来,一碳循环与宫颈癌间的关系逐渐被重视,而叶酸可提供一碳单位,其代谢结果几乎影响着所有细胞生命活动,且也有研究显示,叶酸缺乏与宫颈病变的发生及HPV高易感性相关[7],本研究探讨叶酸营养状况与宫颈癌发生的相关性,以及与术后病理特征的相关性,为探寻宫颈癌危险因素提供新的营养代谢指标。
1 材料与方法
1.1 研究对象
回顾性收集自2020年2月—2022年9月在本院妇科就诊的宫颈癌患者为研究对象,同时纳入健康体检中行高危型HPV检测和薄层液基细胞学(TCT)检查结果正常的女性为对照组研究对象。宫颈癌组患者纳入标准:符合《宫颈癌诊断与治疗指南(第四版)》[8]中宫颈癌的诊断标准;就诊前3个月内未服用叶酸或含有叶酸的营养补充剂;已生育成年女性;就诊期间行高危型HPV检测。排除既往接受过宫颈手术;合并心、肺、肝、肾等严重脏器功能不全;合并其他系统恶性肿瘤及严重生殖系统炎症;妊娠期或哺乳期妇女;子宫先天畸形。依据上述纳入和排除标准,本研究共纳入81例宫颈癌患者和86例正常女性。
1.2 方法
1.2.1 患者一般情况 在患者就诊或体检期间采用健康问卷收集患者一般情况资料,包括年龄、初次性生活年龄、经阴道分娩史、孕次、吸烟、饮酒等。根据患者住院病历及体检报告收集患者高危型HPV(包括16、18、31、33、35、39、45、51、52、53、56、58、59、66、69)感染情况。
1.2.2 患者叶酸营养状况测定 收集对照组和宫颈癌组患者清晨空腹静脉血,叶酸营养状况检测采用生化免疫一体分析仪通过化学发光微粒子免疫分析技术进行。根据叶酸含量正常范围为3.1~19.9 ng/mL,本研究以3.1 ng/mL为标准分为≤3.1 ng/mL和>3.1ng/mL。
1.2.3 宫颈癌患者术后病理信息收集 通过电子病历系统,回顾性分析宫颈癌患者术后病理信息,包括淋巴结转移、脉管转移、分化程度、临床分期。
1.3 统计分析
所有数据及资料收集后录入Epidata数据库进行整理和管理,采用SPSS 16.0进行数据统计分析。计数资料采用频数表示,组间比较采用卡方检验;计量资料采用均数±标准差表示,组间比较采用t检验。采用 Spearson相关探讨叶酸营养状况与宫颈癌发生的相关性,多因素分析采用Logistic多元回归。本研究将P<0.05定义为变量有差异。
2 结果与分析
2.1 研究对象一般情况描述
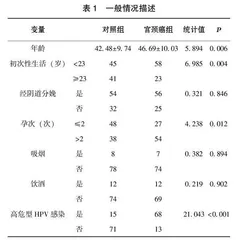
如表1所示,与对照组相比,宫颈癌组患者年龄大,初次性生活年龄<23岁、孕次>2次以及高危型HPV感染者的人数多,差异均有统计学意义(P<0.05)。
2.2 2组研究对象叶酸营养状况比较
如表2 所示,宫颈癌组患者血清平均叶酸水平为(4.76±1.49)ng/mL,低于对照组[(6.03±1.87)vs (4.76±1.49)ng/mL,P=0.011],且宫颈癌患者血清叶酸水平≤3.1 ng/mL人数高于对照组[(19/62)vs (5/81),P=0.009]。
2.3 叶酸营养状况与宫颈癌的相关性分析
采用Sperman相关性分析,探讨血清叶酸水平与宫颈癌的相关性,结果显示,血清叶酸水平与宫颈癌的发生呈显著负相关(r=-0.518,P<0.05)。另外,将一般情况描述中对照组和宫颈癌患者组间有差异的变量纳入多因素分析,年龄、初次性生活年龄≥23岁、感染高危型HPV及叶酸水平≤3.1 ng/mL是宫颈癌发生的危险因素,均有OR>1、P<0.05(表3)。
2.4 宫颈癌患者叶酸营养状况与术后病理特征的相关性分析
如表4所示,叶酸水平≤3.1 ng/mL与淋巴结转移(r=-0.437)、临床分期相关(r=-0.408),均有P<0.05。
3 讨论
叶酸参与的已碳代谢对DNA、RNA、蛋白质的甲基化以及DNA的生物合成和功能维持产生重要影响,而叶酸缺乏或代谢异常则会使这些代谢发生紊乱,进而诱导和加速细胞癌变,故低叶酸状态与癌症的风险增加相关[9-10]。关于叶酸与宫颈癌的关系,一项纳入了6篇病例对照研究的Meta分析结果显示,叶酸缺乏与宫颈癌患病率增加相关,且此种相关在亚洲人群中更为明显[11]。国内一项大型前瞻性队列研究结果也表明,宫颈上皮内瘤变的患病风险与血清叶酸水平呈显著负相关,而合并高危型HPV感染的患者,患病风险更高,即在人群资料中也证实了叶酸缺乏与宫颈癌的发生发展密切相关[12]。
关于叶酸缺乏影响宫颈癌发生发展的机制研究仍在不断深入。首先,高危型HPV感染是宫颈癌发生发展的重要危险因素之一,这与HPV癌蛋白使P53和pRb抑癌基因失活相关[13]。而低叶酸水平会影响16型HPV的DNA基因组整合,进而影响和调节16型HPV的致癌作用[14],且低叶酸水平可通过影响DNA甲基化和染色体损伤等途径,对抑癌基因和促癌基因的表达和活性产生影响,进而导致宫颈癌的发生发展[15]。其次,叶酸可通过影响细胞分裂周期25C表达,对宫颈癌的发生、发展、转移及预后产生一定影响,而25C是特异性磷酸酶家族中的一种细胞周期素,可介导DNA损伤修复,对细胞周期起到调控作用,及叶酸缺乏可通过扰乱细胞周期,影响肿瘤的发生发展[16]。另外,参与叶酸代谢和转运的关键酶5,10-亚甲基四氢叶酸还原酶(MTHFR)和甲硫氨酸合成酶还原酶(MTRR)发生突变会使体内叶酸水平下降,进而影响宫颈癌的发生。除通过影响叶酸水平外,也有研究表明,携带 MTHFR C677T 基因型的患者似乎更易感染 16型和18型HPV,且MTHFR基因C667T多态性是宫颈癌发生的易感因素[17]。
除影响宫颈癌的发生发展以外,本研究还发现,叶酸水平与淋巴结转移和临床分期呈显著负相关,这与国内多项研究结果一致[18-19]。究其原因,可能是叶酸水平低的患者通常伴随着血清高同型半胱氨酸(Hcy)水平,而高Hcy引起的细胞毒性易诱发基因突变,导致细胞增殖异常,进而导致肿瘤的发生,且研究也显示,血清Hcy水平与宫颈癌的分期相关[18]。
综上所述,叶酸营养状况与宫颈癌的发生,术后病理中淋巴结转移及临床分期呈显著负相关,且血清叶酸水平≤3.1 ng/mL是宫颈癌发生的独立危险因素。临床上应关注育龄期女性,尤其是存在高危型HPV感染、宫颈上皮内瘤变患者的叶酸营养状况,及时补充,以预防宫颈癌的发生发展。
参考文献
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA,2018,68(6):394-424.
[2]刘萍. 中国大陆13年宫颈癌临床流行病学大数据评价 [J].中国实用妇科与产科杂志,2018,34(1):41-45.
[3]YUAN Y,CAI X,SHEN F,et al. HPV post-infection microenvironment and cervical cancer [J].Cancer letters,2021,497:243-254.
[4]李靖,刘慧玲,郑胜英. 阴道微环境和HPV感染与宫颈上皮内瘤变的相关性分析 [J].中南医学科学杂志,2022,50(6):926-929.
[5]SU B,QIN W,XUE F,et al. The relation of passive smoking with cervical cancer:A systematic review and meta-analysis [J].Medicine,2018,97(46):e13061.
[6] 崔淑萍. 宫颈癌发生的病因分析及预防措施[J].中国实用医药,2012,7(25):123.
[7]YANG J,YANG A,WANG Z,et al. Interactions between serum folate and human papillomavirus with cervical intraepithelial neoplasia risk in a Chinese population-based study [J].The American Journal of Clinical Nutrition,2018,108(5):1034-1042.
[8]周琦,吴小华,刘继红,等. 宫颈癌诊断与治疗指南(第四版) [J].中国实用妇科与产科杂志,2018,34(6):613-622.
[9]Crider KS,Yang TP,Berry RJ,et al. Folate and DNA methylation:a review of molecular mechanisms and the evidence for folate's role [J].Advances in Nutrition,2012,3(1):21-38.
[10]Myte R,Gylling B,Schneede J,et al. Components of one-carbon metabolism other than folate and colorectal cancer risk [J].Epidemiology,2016,27(6):787-796.