膳食核苷酸对SAMP8小鼠肝纤维化的改善作用
作者: 韦婵 王秀娟 刘睿 徐美虹 珠娜 樊蕊 李勇
摘要:目的:探讨膳食核苷酸对SAMP8小鼠肝脏纤维化的改善作用。方法:采用SPF级SAMP8小鼠48只,按体重随机分为正常对照组、核苷酸低剂量组、核苷酸中剂量组、核苷酸高剂量组,另取12只SAMR1小鼠作为模型对照组。正常对照组、模型对照组均采用基础饲料进行喂养,核苷酸低、中、高剂量组采用额外添加0.3、0.6、1.2 g/kg核苷酸的基础饲料进行喂养。所有组自3月龄开始干预,干预时长9个月。小鼠12月龄时,对小鼠肝组织进行HE染色观察肝脏组织病理学结构,检测肝脏羟脯氨酸、纤维化相关因子和氧化应激指标,同时选取正常对照组和核苷酸低剂量组进行转录组测序,对差异基因进行KEGG富集。结果:与模型对照组相比,正常对照组肝脏组织肝索结构紊乱,肝细胞排列不整齐,炎症细胞浸润。与正常对照组相比,膳食核苷酸显著改善了增龄性肝脏纤维化程度,提高肝脏SOD、GSH-Px活力,降低肝脏脂质过氧化物MDA水平。核苷酸还显著影响了细胞周期、氨基酸的生物合成和糖酵解/糖异生通路。结论:膳食核苷酸对SAMP8小鼠肝脏具有抗纤维化作用。
关键词:肝纤维化;核苷酸;SAMP8小鼠;衰老预计到2050年,全球65岁以上的人口数量将从2010年的5.24亿增加至15亿[1]。全球人口老龄化逐步进展,人口老龄化及衰老相关疾病的高发已成为全世界面临的重大社会和科学问题。衰老导致机体逐渐出现退行性变化。与此同时,随着机体的衰老,衰老细胞逐渐积累,更会加剧机体发生与衰老相关的疾病。肝脏作为机体重要的代谢器官,也会发生结构和功能上的变化[2-3],出现肝细胞排列紊乱、肝血窦明显扩张、纤维化改变、紧密连接的通透性和通过细胞转移的能力减少等。其中,肝纤维化是最重要的表现之一[4]。器官纤维化的发生不仅与衰老密切相关[5],同时也是器官衰老的迹象[6]。随着年龄的增长,实质细胞的再生能力逐渐下降,间质细胞增殖,分泌更多的细胞外基质,加重纤维化的发生。衰老通过阻碍细胞外基质重塑增强小鼠肝纤维化程度[7]。在很多肝脏疾病中,纤维化的易感性随着年龄的增长而增加[8]。肝纤维化逐步进展会发展成为肝硬化,导致正常肝功能的损失,进而导致肝功能衰竭和死亡[9];而因肝硬化死亡人数占全球死亡人数的2.2%,在死因排名中排名第11位[10]。改善衰老肝脏纤维化不仅可以提高肝脏健康与功能,也可以进一步延缓肝硬化的发生,故改善衰老肝脏纤维化对于健康具有重要的意义。
核苷酸作为生命本源物质,是体内生物过程的调节因子,对机体的生长发育、代谢、繁殖和遗传起到重要作用。多代繁殖和终身喂养实验证明,核苷酸是安全且可终身预防性服用,而且核苷酸有调节免疫力、抗感染、促进生长发育、调节肠道菌群功能、改善记忆和保护肝脏等多种生理功能[11]。研究也提示,核苷酸具有延缓衰老的作用[12]。此外,核苷酸可以改善酒精性肝损伤,预防酒精性肝损伤大鼠肝细胞脂肪变性[13],具有很好的保肝作用。目前,关于核苷酸改善SAMP8小鼠肝纤维化的作用的文献报道较少,故本研究以SAMP8雄性小鼠为实验对象,采用膳食核苷酸对小鼠进行干预,通过测定肝组织羟脯氨酸明确膳食核苷酸对SAMP8小鼠肝纤维化的改善作用,同时测定纤维化相关因子和氧化应激指标,进行转录组测序,将差异基因进行KEGG富集探讨膳食核苷酸改善SAMP8小鼠肝脏纤维化可能的机制,为核苷酸的功能开发和作用机制提供科学依据,也为改善肝脏状态与功能提供可能的营养干预方案。
1材料与方法
1.1材料与仪器
核苷酸,白色粉末状固体,是以蔗糖糖蜜为原料发酵,提取核糖核酸,采用酶解法生产分离得到,纯度在99%以上。本研究使用的核苷酸由大连珍奥生物技术股份有限公司提供。基础饲料,购自北京科澳协力饲料有限公司的大小鼠维持饲料。核苷酸干预饲料为在基础饲料的基础上以0.3、0.6、1.2 g/kg的比例额外添加核苷酸的饲料。
健康SPF级SAMP8小鼠和SAMR1小鼠,雄性,10~12 w龄,体重(25±10)g。由北京大学医学部实验动物中心提供。饲养于屏障级动物室,温度范围为 (22±2) ℃,相对湿度为 50%~60%,昼:夜明暗交替时间为12 h:12 h。实验期间动物自由进食与饮水,动物单笼饲养。实验动物许可证号:SYXK(京)2019-0015;实验动物生产许可证号:SCXK(京)2021-0013。
羟脯氨酸测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒、丙二醛(MDA)测定试剂盒,南京建成生物科技;Anti-MMP2抗体、Goat Anti-Rabbit IgG、Anti-beta Actin antibody,Abcam(英国);α-Smooth Muscle Actin (D4K9N) XP Rabbit mAb,CST(美国)。
1.2方法
1.2.1动物分组及处理SAMP8小鼠适应性喂养1 w后,共分为4组:正常对照组、核苷酸低剂量组、核苷酸中剂量组、核苷酸高剂量组;另取12只SAMR1小鼠作为模型对照组。采用不同饲料进行干预,正常对照组和模型对照组采用普通饲料进行干预,核苷酸低、中、高剂量组采用额外添加0.3、0.6、1.2 g/kg核苷酸的基础饲料进行喂养。所有组均自3月龄开始干预,干预9个月。实验过程中每周观察各组小鼠的一般情况,包括毛色、精神状态、摄食及日常活动情况等。12月龄进行相关指标的测定。
1.2.2HE染色实验结束后使用颈椎脱臼法处死小鼠,分离肝脏,同一肝叶位置切去小块肝组织置入4%甲醛缓冲液固定,使用二甲苯透明,石蜡浸泡后包埋,然后进行苏木素染色和伊红染色,最后使用光学显微镜观察并拍照。
1.2.3羟脯氨酸和氧化应激指标测定采用试剂盒测定肝脏羟脯氨酸和氧化应激相关指标(SOD、GSH-Px、MDA)。
1.2.4Western Bolt取冷冻组织蛋白裂解液进行样品制备,使用BCA蛋白定量试剂盒测定蛋白浓度,最后电泳、转膜、封闭、一抗孵育、二抗孵育、显色测定MMP-2、a-SMA蛋白表达量。
1.2.5转录组测序取肝脏组织进行RNA提取、PCR扩增、Illumina 测序、数据质量分析、筛选差异基因进行KEGG富集分析。
1.2.6统计方法正态及非正态分布的连续变量分别以平均数±标准差(x±s)表示;分类变量以个数(百分数)表示。采用SPSS 26.0软件进行单因素方差分析,采用LSD法进行两组间比较;方差不齐时采用Tamhane法进行post-hoc分析。P<0.05表示有统计学意义。
2结果和分析
2.1膳食核苷酸对小鼠肝脏组织病理学的影响
HE染色结果显示,相比于模型对照组,正常对照组肝脏肝索结构紊乱、肝细胞排列不整齐、肝细胞水肿、核固缩。核苷酸低剂量组、核苷酸中剂量组和核苷酸高剂量组肝脏肝索结构排列整齐,肝细胞饱满、肝细胞核正常(图1)。
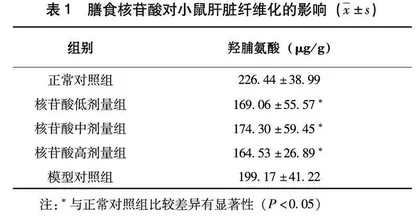
2.2膳食核苷酸对小鼠肝脏羟脯氨酸含量的影响
如表1所示,模型对照组肝脏羟脯氨酸含量低于正常对照组(P>0.05)。核苷酸低剂量组、核苷酸中剂量组和核苷酸高剂量组肝脏羟脯氨酸含量均显著低于正常对照组(P<0.05)。这表明膳食核苷酸具有抗纤维化作用。
2.3膳食核苷酸对小鼠肝脏氧化应激指标的影响
如表2所示,核苷酸低、中、高剂量组肝脏SOD活力显著高于正常对照组(P<0.05);模型对照组肝组织SOD活力显著高于正常对照组(P<0.05)。核苷酸中剂量组肝脏GSH-Px活力显著高于正常对照组和模型对照组(P<0.05);核苷酸低剂量组和核苷酸高剂量组GSH-Px活力高于正常对照组(P>0.05),但差异无显著性;模型对照组肝组织GSH-Px活力与正常对照组相当。核苷酸低剂量组、核苷酸中剂量组和核苷酸高剂量组肝脏MDA含量均显著低于正常对照组和模型对照组(P<0.05)。
2.4膳食核苷酸对小鼠肝脏纤维化相关因子的影响
由图2、图3可知,核苷酸低剂量组a-SMA低于正常对照组(P>0.05),表明核苷酸低剂量组SAMP8小鼠肝星状细胞活化程度较正常对照组低。核苷酸低剂量组、核苷酸中剂量组和核苷酸高剂量组肝脏MMP-2蛋白表达高于正常对照组,但差异无显著性(P>0.05)。
2.5膳食核苷酸对小鼠肝脏转录组测序差异基因KEGG富集通路的影响由图4可知,与正常对照组相比,核苷酸干预得到padj显著的KEGG通路有3条,包括细胞周期(cell cycle)、氨基酸的生物合成(biosynthesis of amino acids)、糖酵解/糖异生(glycolysis/gluconeogenesis)(padj<0.05)。
3讨论
肝纤维化是肝脏出现炎症浸润、受损等情况时,肝脏进行修复,细胞外基质合成降解与沉积不平衡导致。纤维化是慢性疾病的主要发病机制,同时也是导致衰老器官恢复组织功能失败的主要原因。组织病理学结果显示,相比于正常对照组,核苷酸干预组肝索结构正常、肝细胞饱满、肝细胞核大而圆,这表明改善了核苷酸改善了肝组织与衰老相关的变化。羟脯氨酸含量是直接反映纤维化程度的指标,实验结果显示,核苷酸干预显著降低肝脏羟脯氨酸含量,这说明核苷酸干预可以显著改善SAMP8小鼠肝组织纤维化程度。
机体正常代谢会不断产生自由基,当机体处于稳态下,人体可以通过内源性抗氧化剂包括酶与非酶途径及时清除自由基。随着衰老的进程发展,机体内针对自由基堆积的清除会逐渐减弱,导致自由基在体内堆积,对机体内大分子造成氧化损伤堆积,主要表现为脂质过氧化物丙二醛MDA、蛋白质过氧化产物羰基化蛋白等的水平增加[14]。核苷酸干预组显著提高了肝组织SOD和GSH-Px活力,降低了肝脏MDA水平,说明核苷酸显著提高了肝脏抗氧化能力。氧化应激与纤维化密切相关[15-16]。大量研究表明,长时间的炎症和氧化应激可能通过导致肝脏病理性的修复从而促进肝纤维化的发展[17];同时,氧化应激还可能通过影响肝脏细胞功能进而促进肝纤维化的进展[18]。核苷酸显著提高了肝脏的抗氧化能力,清除肝脏过量的自由基,减少了肝脏病理性修复的出现,同时进一步保护了肝脏细胞功能,这可能是核苷酸发挥抗纤维化的机制。
α-SMA是肝星状细胞激活的标志物,α-SMA含量增加意味着肝星状细胞活化程度增加[19-20],肝星状细胞活化与肝脏纤维化密切相关。核苷酸低剂量组肝脏α-SMA蛋白表达低于正常对照组,表明核苷酸低剂量干预可以在一定程度上降低肝星状细胞的活化。核苷酸低剂量干预可能通过降低肝星状细胞活化起到抗纤维化作用。基质金属蛋白酶是负责细胞外基质降解的酶,其中MMP-2是负责降解ECM重要酶之一[21],本研究发现,核苷酸各干预组肝脏MMP-2蛋白的表达均高于正常对照组,这说明,核苷酸可能通过提高MMP-2的表达从而降解细胞外基质,达到抗纤维化的效果。
转录组是针对特定生理条件下所有可检测到的转录产物的集合。RNA-Seq高通量测序通过查找各组样本中差异基因,对差异基因进行富集可以找到干预条件下对样本造成的影响。KEGG富集通路显示,核苷酸干预组细胞周期、氨基酸的生物合成和糖酵解/糖异生等通路与正常对照组显著不同。细胞周期有序进行,促进遗传物质复制、细胞增殖,纤维化进展中,肝细胞在上游调控机制作用下,产生增殖、更新功能异常。核苷酸显著影响肝脏组织细胞周期,提示核苷酸可能通过调节肝细胞周期衰老相关因子,产生延缓肝纤维化作用。核苷酸干预影响肝组织氨基酸的生物合成,这与CAI[13]核苷酸干预酒精性肝损伤的研究结果一致。肝脏作为机体重要的代谢器官,影响其糖酵解/糖异生功能可能改善了其整体功能,糖酵解/糖异生通路的影响可能也是核苷酸改善肝脏纤维化的机制。KEGG富集通路的发现,也更需进一步验证。