外源添加L-苹果酸降低秀丽隐杆线虫体内脂肪含量
作者: 王润圆 赵歆 张梦媛 曾琳 邹伟 王琦
摘要:目的:外源添加L-苹果酸研究其在秀丽隐杆线虫体内对脂肪代谢的影响及调节机制。方法:含L-苹果酸的NGM培养基饲养秀丽隐杆线虫,油红O(ORO)和尼罗红(NR)染色法展示秀丽隐杆线虫体内脂肪,测定线虫体内甘油三酯和脂肪酸含量,qPCR检测fat-5、fat-6、fat-7和sbp-1基因mRNA,同时荧光显微镜观察fat-6:GFP、fat-7:GFP荧光强度的变化。结果:外源添加200、500、1 000 μg/mL L-苹果酸,秀丽隐杆线虫体内脂肪降至83.33%、87.67%、76.67%,甘油三酯(TG)降至0.49、0.61、0.82倍。脂肪酸含量发生变化,C16:1n-7/C16:0和C18:1n-9/C18:0比例降低,抑制硬脂酸C18:0向油酸C18:1n-9的转化,抑制棕榈酸C16:0向棕榈油酸C16:1n-7的转化。1 000 μg/mL L-苹果酸饲养线虫,fat-5、fat-6、fat-7、sbp-1 mRNAs下调为0.46、0.57、0.63、0.50倍;fat-6:GFP和fat-7:GFP荧光强度减弱至0.36和0.28倍。结论:L-苹果酸抑制转录因子sbp-1表达,进而降低fat-5、fat-6、fat-7基因转录,抑制硬脂酸C18:0向油酸C18:1n-9的转化,抑制棕榈酸C16:0向棕榈油酸C16:1n-7的转化,导致线虫脂肪储存的减少。
关键词:秀丽隐杆线虫;L-苹果酸;脂肪代谢;基因表达
机体中,L-苹果酸参与苹果酸天冬氨酸转运过程,具有转移还原型烟酰胺腺嘌呤二核苷酸、还原型辅酶I(NADH)的作用[1-2]。此外,L-苹果酸对机体有较多有益的生理功能,如运动过程中降低血清肌酸激酶水平,减少骼肌损伤[3];减少脂质过氧化增强机体抗氧化能力[4-5];预防老年性痴呆等[6]。L-苹果酸作为低热量的酸味食品添加剂广泛应用于各类食品等的生产加工,可保持食品的口感和色泽[7]。秀丽隐杆线虫作为一种实验模式生物,易于培养、遗传操作简单,通体透明便于观察。更重要的是,哺乳动物中发现的许多核心代谢通路在线虫中相当保守,包括脂肪酸合成、延伸、去饱和和β-氧化,以及神经肽、5 -羟色胺和胰岛素信号通路等。本研究通过外源添加L-苹果酸探索其在秀丽隐杆线虫脂代谢过程中的作用和机制。
1材料与方法
1.1材料与试剂
L-苹果酸,上海生工生物工程有限公司;RNA提取试剂盒、c-DNA合成试剂盒,天根生化科技(北京)有限公司;qPCR引物,由上海生工生物工程有限公司合成;SYBR Green,北京聚合美生物科技有限公司;尼罗红、油红染料,美国Sigma-Aldrich公司;daf-6:GFP和daf-7:GFP线虫,由云南生物资源保护与利用国家重点实验室馈赠。
1.2仪器与设备
倒置荧光显微镜,日本Nikon公司;超声破碎仪,宁波新芝生物科技公司;酶标仪,美国BioTek仪器有限公司;PCR仪,德国Biometra公司;电泳仪、凝胶成像系统,美国Bio-Rad公司;实时荧光定量PCR仪,德国Eppendorf公司;低温高速离心机,美国贝克曼公司;震荡仪,海门市其林贝尔仪器制造有限公司;旋涡混合器,北京金紫光科技发展有限公司。
1.3方法
1.3.1秀丽隐杆线虫培养使用大肠杆菌OP50菌株作为食物源,将其均匀涂于线虫生长的培养基(NGM)上。将同步化后的800~1 000条左右的L1的线虫接种于涂布了OP50的NGM平板上,20 ℃培养2 d至产1~3颗卵的成虫期备用。
1.3.2脂肪酸测定培养线虫至产1~3颗卵的成虫期,用单蒸水洗脱5~10个培养皿的线虫至8 mL GC专用玻璃管中,置于冰上沉淀。单蒸水清洗2次,待虫体沉淀后去除上清。液氮速冻保存于-80 ℃冰箱。加入1 mL酯化液,70 ℃水浴锅酯化1~2 h,冷却后加入1.5 mL双蒸水和200 μL正己烷,剧烈震荡。4 000 r/min离心2 min后分2层,上层有机相为酯化脂肪酸。取上层有机相80 μL置于GC玻璃瓶中(加入衬管),上机检测[8]。
1.3.3油红O(ORO)染色500 mg ORO粉溶于100 mL异丙醇,制成母液避光密封保存备用。使用前以去离子水按3∶2比例稀释异丙醇油红O母液,震荡2 h使其充分溶解,用0.2 μm微孔滤膜过滤杂质制备为工作液,锡箔纸包裹避光冰箱储存备用。以PBST(含0.01% Triton)将携带1~3个虫卵的成虫轻洗于1.5 mL离心管中,反复清洗3次至澄清状态无菌。以560 g离心1 min去掉上清,留100 μL重悬,加入600 μL 40%异丙醇在室温下震荡孵育3 min,560 g离心1 min,去上清,留100 μL重悬。加入600 μL ORO工作液混匀,将样品在室温下避光旋转孵育2 h,560 g 离心1 min,去上清留100 μL。加入600 μL PBST重悬,在避光条件下旋转孵育30 min去除多余ORO染色剂,560 g离心1 min,留50 μL上清液。取15 μL线虫悬浮液置于载玻片上,相同曝光时间进行白光拍照。实验重复3次,每个组拍摄不少于20条。
1.3.4尼罗红(NR)染色100 mg NR粉溶于200 mL丙酮,避光搅拌2 h,-20 ℃冰箱密封储存备用。使用前,6 μL储备液溶于1 mL 40%异丙醇中制备为工作液。PBST(含0.01% Triton)将携带1~3个虫卵的成虫轻洗于1.5 mL离心管中,反复清洗3次至肉眼澄清无菌,以560 g离心1 min去除上清液。加入100 μL 40%异丙醇,并在室温下震荡孵育3 min,再以560 g离心1 min,去上清。加入600 μL的尼罗红工作液混匀,室温下避光旋转孵育2 h。560 g离心1 min去上清,加入600 μL PBST进行重悬,避光旋转孵育30 min以去除多余NR染色剂,560 g离心1 min,留50 μL上清液重悬。取15 μL线虫悬浮液置于载玻片上,使用FITC/GFP通道,相同曝光时间进行成像。实验重复3次,每个组拍摄不少于20条。
1.3.5甘油三酯检测用PBS缓冲液将携带1~3个虫卵的成虫从生长板上洗下,收集于无菌的1.5 mL EP管中,清洗至肉眼无菌。超声细胞破碎仪对线虫进行破碎匀浆处理(冰水浴、超声功率150 W、时间3 min),破碎匀浆后以2 000 r/min离心10 min,将上清液转移至新的1.5 mL的EP管中待测。按照甘油三酯检测试剂盒说明,使用96孔板进行检测,在空白孔里加入10 μL蒸馏水和1 000 μL的工作液,标准孔里加入校准品10 μL和1 000 μL工作液,各个样本孔中加入样本10 μL和1 000 μL工作液,混匀后在37 ℃避光孵育10 min,酶标仪,波长510 nm,测定各孔OD值。每个组平行测定3次,取OD值得均值计算甘油三酯的含量。同时以BCA法测定各组样本蛋白的浓度。
1.3.6FAT-6:GFP和FAT-7:GFP荧光强度观察将同步化后孵化的fat-6:GFP、fat-7:GFP L1线虫转移至含L-苹果酸0、200、500、1 000 μg/mL 的NGM培养皿中,在标准条件下培养至携带1~3个虫卵的成虫。M9洗下后吸取15 μL制片,在荧光显微镜下使用FITC/GFP通道观察。
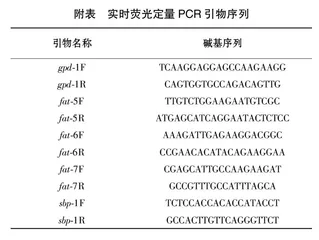
1.3.7qPCR分析收集L4期线虫,按宝生物工程(大连)有限公司的RNA提取试剂盒的步骤提取线虫的总RNA,并测定其含量。按天根生化科技有限公司的逆转录试剂盒步骤来合成cDNA,反应体系:SYBR green mix 10 μL、上游引物0.5 μL、下游引物0.5 μL、cDNA 2 μL、ddH2O 10 μL,使用罗氏荧光定量PCR仪进行定量。我们以gpd-1为内参基因,用2-ΔΔCt计算基因转录水平差异,引物序列见附表。
1.3.8数据处理及分析使用GraphPad 8.4.0版本软件对数据进行作图和统计学分析,t检验进行两两比较,单因素方差分析进行组间比较,以P<0.05为差异有统计学意义。
2结果与讨论
2.1外源添加L-苹果酸可减少秀丽隐杆线虫体内脂肪含量
秀丽隐杆线虫体脂主要储存于肠上皮细胞和肠道中,ORO和NR染色法能客观地展示秀丽隐杆线虫体内脂肪[9-10]。采用ORO染色、NR染色和TG含量测定3种方法对线虫体内脂肪进行分析。将同步化后500条左右L1线虫分别加至含L-苹果酸0、200、500、1 000 μg/mL的NGM平板,培养至携带1~3个虫卵的成虫,进行ORO染色和NR染色。其中NR染色表明,与对照组(0 μg/mL)相比,200、500、1 000 μg/mL L-苹果酸喂养线虫脂肪颗粒数量减少(图1A);脂肪颗粒体积减小(图1A),由1.66 μm分别减小至1.43、1.17、1.05 μm(图1C)(P<0.05)。ORO染色表明,与对照组(0 μg/mL)相比,200、500、1 000 μg/mL L-苹果酸喂养线虫脂肪含量分别降至83.33%、87.67%、76.67%(图1B、D)(P<0.05)。同时,根据TG含量的测量结果,与对照组(0 μg/mL)相比,200 、500 、1 000 μg/mL L-苹果酸喂养线虫TG含量分别降至0.49、0.61、0.82倍(图1E)(P<0.05)。综上所述,外源添加200、500、1 000 μg/mL L-苹果酸喂养线虫,脂肪颗粒的数量减少、体积减小,降低体内脂肪含量。
2.2外源添加L-苹果酸对脂肪酸含量的影响
将同步化后500条左右L1线虫分别加至含L-苹果酸0、200、500 μg/mL的培养基中培养线虫至携带1-3个虫卵的成虫,分别收集5-10个培养皿的线虫测定各类脂肪酸含量。与对照组(0 μg/mL)相比,200 μg/mL L-苹果酸饲养线虫后,脂肪酸含量C15 iso由3.42%降至2.8%、C17 iso由5.5%降至4.29%、C20:5n-3由17.00%降至9.77%(P<0.05),脂肪酸含量C16:0由3.4%增至4%、C17 Δ由6.13%增至7.23%、C19 Δ含量由8.10%增至8.59%(P<0.05),脂肪酸含量C14:0由0.95%变为0.92%、C16:1n-7由3.47%变为3.44%、C17:0由1.24%变为1.45%、C18:0由5.56%变为5.94%、C18:1n-9由2.66%变为3.00%、C18:1n-7由25.96%变为30.23%、C18:2n-6由5.34%变为5.35%、C18:3n-6由1.88%变为2.02%、C20:3n-6由3.17%变为3.12%、C20:4n-6由1.64%变为1.62%、C20:4n-3由4.44%变为4.20%,含量无明显变化(P>0.05)(图2)。500 μg/mL L-苹果酸喂养线虫后,C15 iso由3.42%降至2.40%、C16:1n-7由3.48%降至2.28%、C17 iso由5.50%降至3.83%、C18:2n-6由5.35%降至4.62%、C18:1n-9由2.66%降至1.53%、C20:4n-6由1.62%降至1.15%、C20:4n-3由4.44%降至3.81%、C20:5n-3由17.00%降至13.55%(P<0.05),脂肪酸C17 Δ由6.13%增至11.85%、C18:0由5.67%增至6.37%、C19 Δ由8.10%增至9.83%(P<0.05),脂肪酸C14:0由0.95%变为0.94%、C16:0由3.40%变为3.50%、C17:0由1.24%变为1.51%、C18:1n-7由25.96%变为28.51%、C18:3n-6由1.88%变为2.05%、C20:3n-6由3.17%变为2.88%,含量无明显变化(P>0.05)(图2A-C)。此外,与对照组(0 μg/mL)相比,200、500 μg/mL L-苹果酸喂养线虫后C16:1n-7/C16:0由1.02降至0.86和0.65(P<0.05)(图2D);C18:1n-9/C18:0的比例由0.47变为0.50(P>0.05)和0.24(P<0.05),C16:1n-7/C16:0和C18:1n-9/C18:0比例降低。脂肪中的单不饱和脂肪酸棕榈油酸C16:1n-7和油酸C18:1n-9是生物合成甘油三酯、磷脂、胆固醇酯等的重要底物。C16:1n-7/C16:0和C18:1n-9/C18:0比例降低,表明L-苹果酸抑制了硬脂酸C18:0向油酸C18:1n-9的转化,同时抑制了棕榈酸C16:0向棕榈油酸C16:1n-9的转化,导致线虫脂肪储存减少。