两种测定肉制品中牛、猪源性成分的方法对比研究
作者: 龚晓咏 高嘉明 张琴
随着经济的发展,人们对肉类的需求量日益增长,一些无良商家为了牟取暴利,掺假现象层出不穷,对人的身体健康造成危害。目前,在生物学领域鉴定动物源性成分的方法以核酸分析为主,检测方法有实时荧光PCR、普通PCR、聚合酶链式反应-限制性片段长度多态性、PCR-限制性片段长度多态性(PCR-RFLP)等。其中,实时荧光PCR技术凭借简便、高效等特点,广泛应用于肉制品的检测中,具有广阔的发展前景。该技术通过物种特异性引物探针进行扩增,实时监控整个检测过程。试剂盒法利用PCR具有特异性强、灵敏度高、操作简便、省时等特点,加上自带内参检测条件的优势,更能有效避免假阴性率,是今后检测的一个重要方向。本次检测按照GB/T 38164-2019和SN/T 2051-2008的要求对肉制品中牛、猪源性成分进行了分析,对比了两种检测方法的检出限、灵敏度、特异性等,分析了不同检测方法之间的差异性,及在实际应用中的优势。
一、材料与方法
1.样品采集。样品采集于大型商场、农贸市场、电商平台,随机购买预包装牛肉丸、生鲜牛肉各10份。预包装牛肉丸成分表均显示有牛肉成分,无标注猪肉成分,日期在有效期内并包装完好。生鲜牛肉均为未分切部分,一个样品分装在一个袋子中,做好编号,冷藏运送于实验室。
2.主要试剂和仪器设备。各阳性标准物质(均由正规公司购入),TaKaRa DNA提取试剂盒,牛、猪源性成分实时荧光PCR检测试剂盒,猪、牛、内参基因的引物探针(均由生工生物工程(上海)股份有限公司购买合成),PCR Master Mix(2X),实时荧光定量PCR仪,高速台式冷冻离心机(最高转速12000r/min以上),小型台式恒温摇床,微量可调移液器及配套吸头(10uL、100uL、1000uL),离心管等。
3.方法。(1)前处理。生鲜牛肉:经70%乙醇和蒸馏水冲洗3遍,捣碎,收集到干净50mL离心管中,依次做好编号,并于-20℃以下保存。牛肉丸:捣碎,收集到干净50mL离心管中,依次做好编号,并于-20℃以下保存。
(2)DNA提取。两个标准明确,均可用等效商品化DNA提取试剂盒提取DNA,本实验采用的是TakaRa品牌,验收结果满意。具体流程按照说明书规范操作,收集的模板DNA溶液于-4℃保存。
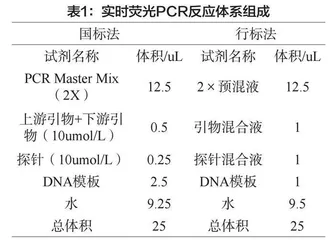
(3)扩增试剂准备。国标法:将用到的试剂回温并颠倒混匀,2000r/min离心10s,引物探针需由储备液配制成工作液,设所需的PCR反应管为n(n=1阳性对照+1阴性对照+1空白对照+样本数),按表1计算好各试剂所需量,加入离心管中,完全混匀并在2000r/min条件下离心10s,分别向设定的各反应管中加入22.5uL。每个项目的配制操作均一致,需另外配制内参的体系。
行标法:将试剂盒回温并混匀离心,试剂盒中已包含表1中的试剂均可直接使用,如国标法所示设置好相应数量的反应管数,分别加入24uL反应体系,混匀待用。无需配制内参体系,本试剂盒自带内参。
(4)加样。向体系中加入DNA模板,以含目标成分的标准物质为阳性对照,用水作为阴性、空白对照,样品反应管加入样品DNA提取待测液。加入量见表1。
(5)实时荧光PCR扩增。分别进行靶向基因和内参基因扩增,以Ct值平均值作为最终结果。国标法的反应参数为:95℃、10min,95℃、15s,60℃、1min,40个循环;行标法的参数为:95℃、10s,95℃、5s,60℃、20s,40个循环。
(6)反应参数优化。由于国标法的扩增时间过长,通过反复对反应参数进行调整测试,设置测量动物源性成分的最佳条件如下所示:95℃、10s,95℃、5s,60℃、34s,40个循环,该条件下对实验结果无影响。本实验的结果均使用优化后的反应参数进行扩增。
(7)结果的判断。国标法:在内参、空白及阴、阳性对照成立的情况下,Ct值≤35.0表示被检样品是阳性;Ct值≥40.0表示被检样品为阴性;若35<Ct值<40.0,则重复一次,如Ct值<40.0为阳性,Ct值≥40.0为阴性。行标法:在HEX通道结果满足的情况下,被测样品有FAM荧光检出且Ct值<35.0,表示被检样品为阳性,无FAM荧光检出且Ct值>35.0,表示被检样品为阴性。
二、结果与分析
1.检出率。根据检测标准,分别对10份牛肉丸和生鲜牛肉进行牛、猪源性成分的检测,通过PCR技术扩增,以Ct值的平均值为最终结果。用两个标准检测的生鲜牛肉、牛肉丸的牛源性成分检出率均为100%,生鲜牛肉的猪源性成分检出率0%,牛肉丸的猪源性成分检测结果见表2。其中,国标法检出5份有猪源性成分,行标法检出7份有猪源性成分,表明产品存在与成分表不符的现象。Ct值越大,说明猪源性成分越多,通过对比样品8、9可知,浓度较低的样品,利用国标法可能存在假阴性结果,造成漏检的现象,行标法的检出率更高。
2.最低检出限。选取3份未检出猪源性成分的生鲜牛肉,各称取25mg,分别加入100%、10%、1%、0.1%、0.01%浓度的猪阳性标准溶液,利用商品化试剂盒进行DNA提取,过程中防止交叉污染,以样品空白、试剂空白作为质控手段。体系配制和DNA扩增根据相应标准进行,通过实时荧光PCR仪进行扩增,以各浓度Ct值的平均值作为最终结果。
当阳性标物浓度为100%、10%、1%,两个标准均可检出猪源性成分,行标法的Ct值更加稳定。浓度为0.1%时,国标法的Ct值>40.0,未检出猪源性成分,而行标法在0.1%时,Ct值仍<35.0,且数据稳定,0.01%时未检出猪源性成分。国标法的最低检出限可达到1%,行标法为0.1%。
3.特异性。对10份生鲜牛肉进行猪源性成分的检测,均未检出猪源性成分,说明这10份原材料不存在掺假猪肉的现象。在此前提下,利用牛的特异性引物探针配制体系,分别加入已稀释过不同浓度的牛、猪标准物质DNA溶液进行干扰,采取增加提取空白、扩增空白等手段来验证其准确度,用两种方法对其进行DNA扩增,结果均检出牛源性成分,未检出猪源性成分。这说明两种方法的特异性均较好,是排除假阳性的有效手段之一。
三、讨论
通过方法差异性、检出率、最低检出限、特异性对现行的两个标准进行试验比对,目的是找到更适用鉴定牛肉、牛肉丸这类肉制品是否掺假的方法,提高数据的准确性,从而为打击掺假行为提供有效的技术支持。
在方法差异性方面,国标法在体系配制环节较为传统,需要根据标准合成相应的碱基序列的引物探针,使用前需配置成工作液,容易导致浓度过高或过低,储备液的反复冻融加大了污染的概率并且容易失活,导致试剂的灵敏度降低。行标法具有简便、快速、耗时短、抗污染性强等特点,试剂盒自带内参照、水、阳性DNA等,只需按比例配成体系即可,减少了实验人员因操作不当带来的污染,同时自带的内参照也可以有效避免假阴性的结果,弥补了国标法的不足,但是价格稍高。
反应参数的选择和设置,是扩增的关键点之一,在不影响检测数据的前提下可以对国标法进行优化,此优化主要参考试剂盒法的反应参数。优化后的参数设置,不仅可以缩短扩增时间,不同的项目也可以一起扩增,很大程度上缩短了检测时间,提高了检测效率。
在检出率方面,两个标准略有差异。当出现外源基因Ct值在临界值时,应考虑是否因实验员操作不当、耗材间出现交叉污染、样品在生产流通环节存在污染等因素,通过增加质控手段对整个实验进行监控,排除可能造成结果差异性的外在因素。行标法检出阳性率比国标法高,取决于二者的最低检出限,行标法较低的检出限是筛查外源基因含量低的好方法,以防漏检,客观反映数据的真实性。
基于二者的试验比对结果,两个标准均可检测出肉制品中的掺假成分,具备较强的特异性、良好的灵敏度、较高的准确度。行标法比国标法略有优势,但价格较昂贵。相比之下,行标法检出限较低,可以有效排除漏检现象,试剂盒快速、简便、准确的特点也可应对繁重的检测任务。因此,在考虑时间成本和效率的情况下,建议使用行标法对该类产品进行检测,必要时也可两个标准配合使用,提供真实、有效的数据,更好地保障消费者权益。
作者简介:龚晓咏(1996-),女,汉族,广东广州人,助理工程师,大学本科,研究方向为食品营养。
高嘉明(1991-),女,汉族,广东广州人,工程师,大学本科,研究方向为食品营养。
张琴(1986-),女,汉族,海南人,工程师,大学本科,研究方向为食品营养。