凝胶色谱净化-气相色谱法测定坚果中BHA、BHT和TBHQ的含量
作者: 李文玲 刘建春 武利珏
摘 要:目的:建立凝胶色谱净化-气相色谱法测定坚果中叔丁基对羟基茴香醚(Butylated Hydroxyanisole,BHA)、2,6-二叔丁基对甲基苯酚(Butylated Hydroxytoluene,BHT)、特丁基对苯二酚(Tertiary Butylhydroquinone,TBHQ)含量的分析方法。方法:坚果样品用石油醚提取,经凝胶色谱系统净化,旋转蒸发浓缩后,用气相色谱外标法定量检测。结果:3种抗氧化剂在0.01~0.10 mg·mL-1线性关系良好,方法检出限与定量限分别为0.002 g·kg-1和0.005 g·kg-1,加标回收率在89.15%~104.40%,精密度在1.85%~4.87%。结论:该方法准确可靠,适用于食品检验检测机构对坚果中3种抗氧化剂的检测。
关键词:抗氧化剂;坚果;凝胶色谱净化-气相色谱法
Abstract: Objective: The method for the determination of butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT) and tertiary butylhydroquinone (TBHQ) in nuts by gel chromatography purification-gas chromatography was established. Method: The nut sample was extracted with petroleum ether, purified by gel chromatography system, concentrated by rotary evaporation, and determined by external standard method of gas chromatography. Result: The three antioxidants showed a good linear relationship within the range of 0.01~0.10 mg·mL-1, with detection and quantification limits of 0.002 g·kg-1 and 0.005 g·kg-1 respectively. The recovery rate ranged from 89.15%~104.40%, and the precision ranged from 1.85%~4.87%. Conclusion: This method is accurate and reliable, and is suitable for food inspection and testing institutions to detect three types of antioxidants in nuts.
Keywords: antioxidant; nuts; gel chromatography purification-gas chromatography
坚果营养丰富,富含蛋白质、矿物质、维生素等有益成分,有增强体质、明目健脑、预防疾病等功效。然而,坚果炒货食品中油脂含量较高,在加工储运等过程中较易出现油脂氧化酸败,导致食品出现异味,并对食用者的身体健康产生威胁,所以坚果炒货加工过程中通常会加入抗氧化剂来抑制油脂的氧化[1]。叔丁基对羟基茴香醚(Butylated Hydroxyanisole,BHA)、2,6-二叔丁基对甲基苯酚(Butylated Hydroxytoluene,BHT)、特丁基对苯二酚(Tertiary Butylhydroquinone,TBHQ)是3种常用的人工合成抗氧化剂,在食用油、坚果炒货等加工中运用较广泛,有效延长了产品的货架期与保质期,但过量使用抗氧化剂,人体摄入后会产生DNA损伤、致癌等,因此加强坚果炒货食品中BHA、BHT、TBHQ等抗氧化剂的检测非常必要[2]。本研究参照《食品安全国家标准 食品中9种抗氧化剂的测定》(GB 5009.32—2016)[3]中第四法气相色谱法,结合实验室条件设备,建立了凝胶色谱净化-气相色谱法测定坚果中BHA、BHT和TBHQ含量的方法。
1 材料与方法
1.1 材料与试剂
BHA标准品(纯度99.51%),德国DrEhrenstorfer公司;BHT标准品(纯度99.9%)、TBHQ标准品(纯度99.7%),均购于北京TMstandard公司;乙腈、正己烷、石油醚(沸程30~60 ℃),均为色谱纯,购于美国Thermo fisher公司;实验室用水为一级超纯水。
1.2 仪器与设备
7890A气相色谱仪(配FID检测器),美国安捷伦公司;Preplinc全自动凝胶净化系统,美国J2 Scientific公司;ME3002E电子天平(精度0.01 g)、AL104分析天平(精度0.1 mg),瑞士梅特勒托利多公司;VORTEX MS3旋涡混合仪,德国艾卡公司;P/N Hei-VAP Precision ML/G3旋转蒸发仪,德国海道夫公司;Synergy超纯水机,德国密理博公司。
1.3 试验方法
1.3.1 标准溶液配制
(1)混合标准储备溶液。准确称取BHA、BHT、TBHQ标准品各0.005 0 mg于烧杯中,用乙酸乙酯和环己烷混合溶液(1+1,V/V)全部转移至50 mL棕色容量瓶中,定容,摇匀,配制成BHA、BHT、TBHQ浓度均为1.0 mg·mL-1的混合储备液,于4 ℃冰箱避光保存。
(2)混合标准工作系列。分别吸取BHA、BHT、TBHQ混合储备液0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL于6个10 mL的容量瓶中,用乙酸乙酯和环己烷混合溶液(1+1,V/V)稀释并定容,配制成浓度分别为0.01 mg·mL-1、0.02 mg·mL-1、0.04 mg·mL-1、0.06 mg·mL-1、0.08 mg·mL-1和0.10 mg·mL-1的BHA、BHT、TBHQ混合标准工作系列。
1.3.2 试样处理过程
称取5.00 g(精确至0.01 g)粉碎混匀的坚果试样,置于250 mL具塞三角瓶中,加入石油醚至完全浸没试样,静置过夜,经快速滤纸过滤,滤液收集于旋蒸瓶中,旋转蒸发得到油脂。
准确称取0.500 0 g(精确至0.000 1 g)旋转蒸发得到的油脂,用乙酸乙酯和环己烷混合溶液(1+1,V/V)稀释,全部转移入10 mL容量瓶中,定容,涡旋混匀后,待净化。
将上述待净化液过0.45 μm有机滤膜,转移至凝胶色谱专用样品瓶中,置于全自动凝胶净化色谱仪上,经过凝胶色谱装置净化,收集流出液,旋转蒸发至近干,用乙酸乙酯和环己烷混合溶液(1+1,V/V)复溶,定容至1.0 mL,供气相色谱仪测试。
1.4 仪器测定条件
1.4.1 凝胶净化条件
凝胶色谱柱:CO115快速净化柱;流动相:乙酸乙酯+环己烷(1+1,V/V);流速:5 mL·min-1;进样量:5 mL;流出液收集时间:15.50~25.50 min;紫外检测器波长:254 nm。
1.4.2 气相色谱条件
色谱柱:DB-1701毛细管色谱柱(30 m×0.25 mm,0.25 μm);载气:高纯氮;柱流速:1.0 mL·min-1;进样口温度:230 ℃;进样方式:不分流进样;柱箱温度:80 ℃保持1 min,以10 ℃·min-1升温至230 ℃保持10 min;FID检测器温度:250 ℃;氢气流量:30 mL·min-1;空气流量:400 mL·min-1;尾吹氮气流量:30 mL·min-1。
2 结果与分析
2.1 色谱分离分析
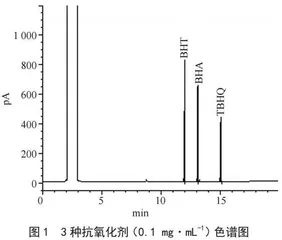
将配制的BHA、BHT、TBHQ浓度为0.1 mg·mL-1的混合标准工作溶液在1.4.2气相色谱条件下上机测试,26 min内可以完成3种抗氧化剂的在线分析,色谱图如图1所示。3种抗氧化剂组分的色谱峰尖锐对称,完全分离。进一步对试剂空白、阴性坚果及加标样品进行测试,虽然坚果样品中杂质较多,但是经过净化处理后试样中杂质峰、溶剂峰等并未对3种抗氧化剂组分产生干扰,可以进行准确的定性定量分析。
2.2 线性关系、检出限与定量限
将配制的BHA、BHT、TBHQ混合标准工作系列在1.4.2气相色谱条件下上机测试,以3种抗氧化剂组分的浓度为横坐标,相对应测得的色谱峰面积为纵坐标,采用仪器配置的ChemStation工作站自动绘制标准工作曲线,计算线性回归方程与相关系数。根据3倍信噪比(3S/N)对应的目标组分含量计算方法检出限,10倍信噪比(10S/N)对应的目标组分含量计算方法定量限,结果见表1。
由表1中数据可知,3种抗氧化剂组分在0.01~0.10 mg·mL-1线性关系良好,相关系数r均大于0.999,满足《合格评定 化学分析方法确认和验证指南》(GB/T 27417—2017)[4]中对标准曲线线性的要求。方法检出限均为0.002 g·kg-1,定量限均为0.005 g·kg-1,满足GB 5009.32—2016中对定性与定量方法的要求。
2.3 方法的加标回收率与精密度
在3种代表性的阴性坚果样品(核桃、瓜子、蚕豆)中,根据3种抗氧化剂的方法定量限和《食品安全国家标准 食品添加剂使用标准》(GB 2760—2014)[5]中的最大使用量(以油脂中的含量计),添加低(1倍定量限0.005 g·kg-1)、中(2倍定量限0.010 g·kg-1)、高(最大使用量0.200 g·kg-1)3种浓度水平的混合标准溶液,按照1.3.2试样处理过程与1.4仪器测定条件对每个浓度水平平行测定6次,计算加标回收率与精密度。由表2中数据可知,3种坚果样品中BHA的回收率为91.23%~103.50%,精密度RSD为1.85%~4.41%;BHT的回收率为93.17%~103.90%,精密度RSD为2.35%~4.87%;TBHQ的回收率为89.15%~104.40%,精密度RSD为2.12%~4.55%,加标回收率与精密度均符合《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)[6]中的规定。
3 结论
本研究建立了凝胶色谱净化-气相色谱法测定坚果中BHA、BHT和TBHQ含量的分析方法。实验结果表明,坚果中3种抗氧化剂经石油醚提取、凝胶色谱系统净化、气相色谱检测,方法的线性关系良好,检出限与定量限较低,加标回收率及精密度均符合相关标准的规定,可以满足食品检验检测实验室对坚果样品中BHA、BHT和TBHQ的高通量检测需求。
参考文献
[1]谢玉鹏.不同抗氧化剂在坚果炒货食品中应用研究[J].现代食品,2019(1):151-153.
[2]廖梦莎,刘香香.气相色谱-质谱法同时测定坚果中的4种抗氧化剂[J].四川农业科技,2020(8):56-58.
[3]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中9种抗氧化剂的测定:GB 5009.32—2016[S].北京:中国标准出版社,2016.
[4]国家质量监督检验检疫总局,中国国家标准化管理委员会.合格评定 化学分析方法确认和验证指南:GB/T 27417—2017[S].北京:中国标准出版社,2017.
[5]国家卫生和计划生育委员会.食品安全国家标准 食品添加剂使用标准:GB 2760—2014[S].北京:中国标准出版社,2014.
[6]国家质量监督检验检疫总局,中国国家标准化管理委员会.实验室质量控制规范 食品理化检测:GB/T 27404—2008[S].北京:中国标准出版社,2008.