高效液相色谱法测定固体饮料、糖果中的β-胡萝卜素
作者: 甘旺
摘 要:目的:建立固体饮料、糖果中β-胡萝卜素的提取方法,利用高效液相色谱法测定样品中β-胡萝卜素含量。方法:称取均匀试样,添加抗氧化剂,加水分散溶解、石油醚-丙酮(体积比为1∶1)萃取、水洗、浓缩后复溶用高效液相色谱法测定β-胡萝卜素的含量。结果:在β-胡萝卜素含量0.5~10.0 μg·mL-1范围内,线性相关系数R=0.999 5,呈良好相关性,样品平均加标回收率在91.9%~99.3%,相对标准偏差在1.14%~3.59%。结论:该方法相较《食品安全国家标准 食品中胡萝卜素的测定》(GB 5009.83—2016)更简单、快速,能有效降低前处理过程中氧化损失,可用于固体饮料、糖果中β-胡萝卜素的测定。
关键词:高效液相色谱法;β-胡萝卜素;固体饮料;糖果
Determination of β–Carotenoids in Solid Beverages and Confectionery by High Performance Liquid Chromatography
Abstract: Objective: To establish an extraction method for β-carotene in solid beverages and candies, and to determine the content of β-carotene in the samples using high-performance liquid chromatography. Method: Weigh a uniform sample, add antioxidant, disperse and dissolve in water, extract with petroleum ether acetone (1∶1), wash with water, concentrate, and then dissolve again. Determine the content of β - carotene by HPLC. Result: The linear coefficient R was 0.999 5 within the range of β - carotene content from 0.5 μg·mL-1 to 10.0 μ g·mL-1, showing good linearity. The sample recovery rate was from 91.9% to 99.3%, and the average relative standard deviation was from 1.14% to 3.59%. Conclusion: This method is simpler and faster compared to GB 5009.83—2016, and can effectively reduce oxidative losses during pretreatment. It can be used for the determination of β - carotene in solid beverages and candies.
Keywords: high-performance liquid chromatography; β-carotene; solid beverages; candy
β-胡萝卜素为橘黄色脂溶性化合物,是自然界中普遍存在的天然色素。β-胡萝卜素在样品中分为游离态和结合态两种形式,天然食品中的β-胡萝卜素多为结合态胡萝卜素。β-胡萝卜素具有营养保健作用以及很强的抗氧化作用,被广泛添加到食品中,一定条件下能在体内转化为维生素A,起到保护视力、预防夜盲症、干眼症等作用[1-4]。
β-胡萝卜素的常用检测方法有高效液相色谱法[5-6]、紫外-可见光谱法[7-8]、荧光光谱法[9],其中高效液相色谱法是检测β-胡萝卜素最常用的方法。《食品安全国家标准 食品中胡萝卜素的测定》(GB 5009.83—2016)中皂化的前处理方式适用于大部分食品中β-胡萝卜素的测定。然而对于固体饮料、糖果等类别食品,β-胡萝卜素多为人工添加,本身属于游离状态,可省去皂化步骤,简化检测流程。
β-胡萝卜素分子式中的多共轭双键结构易受到外界条件,如光、热、氧等因素的影响而产生异构和转化。皂化过程中的加热、碱浓度都会影响β-胡萝卜素的测定。SUNDARESAN等[10]针对膳食补充剂中β-胡萝卜素含量测定,发现皂化会造成复合维生素-复合矿物质片中55%的β-胡萝卜素损失,而用55~60 ℃热水溶解片剂后,用有机溶剂直接提取能得到更接近样品理论值的分析结果。国内相关研究表明,皂化温度与萃取次数对胡萝卜素的检测有较大影响[11-14]。
1 材料与方法
1.1 材料、试剂与仪器
固体饮料1、固体饮料2、压片糖果1、压片糖果2和软糖,均为市售。β-胡萝卜素标准品,ANPEL公司;氢氧化钾、无水硫酸钠、石油醚和无水乙醇,广州化学试剂厂;抗坏血酸,Sigma公司;甲醇、乙腈、三氯甲烷和二氯甲烷,均为色谱纯,Merck公司;2,6-二叔丁基-4-甲基苯酚,Sigma公司;实验室用水(超纯水)。
UltiMate3000液相色谱仪,德国Thermo;EFAA-DC-24全自动氮吹仪,上海安谱;Milli-Q Reference超纯水系统,法国Millpore;万分之一电子天平,德国赛多利斯;旋转蒸发仪,德国Heidolph。
1.2 试验方法
1.2.1 标准溶液的配制
①标准储备液(100 μg·mL-1):准确称取β-胡萝卜素对照品10.0 mg(精确到0.1 mg),加入0.25 g 2,6-二叔丁基-4-甲基苯酚,用二氯甲烷溶解,转移至100 mL棕色容量瓶中定容至刻度,于-20 ℃避光保存。②标准工作液:分别精密量取储备液0.05 mL、0.10 mL、0.20 mL、0.30 mL、0.40 mL和1.00 mL标准储备液于10 mL棕色容量瓶中,用二氯甲烷定容至刻度,摇匀,得到β-胡萝卜素的浓度分别为0.5 μg·mL-1、1.0 μg·mL-1、2.0 μg·mL-1、3.0 μg·mL-1、4.0 μg·mL-1和10.0 μg·mL-1。
1.2.2 样品前处理(不含皂化步骤)
称取1~2 g试样,加入1 g抗坏血酸,加50 mL水混匀,于25 ℃摇床振荡处理30 min后,将试液转入250 mL分液漏斗,加入50 mL萃取试剂,轻轻摇动,排气,盖好瓶塞,振摇3 min后静置分层,重复萃取3次。合并有机相,用水洗至中性,弃去水相,有机相通过无水硫酸钠过滤除水,转入旋转蒸发瓶,40 ℃减压浓缩,近干。氮气吹干,用5.00 mL二氯甲烷定容,经0.45 μm膜过滤后上机检测。
1.2.3 样品前处理(含皂化步骤)
称取1~2 g试样,加入1 g抗坏血酸,加50 mL水混匀,加入75 mL无水乙醇,摇匀,再加入25 mL 50%浓度的氢氧化钾溶液,盖上瓶塞。置于已预热至(53±2)℃恒温振荡水浴箱中,皂化30 min。取出,静置,冷却至室温。将试液转入250 mL分液漏斗,加入50 mL萃取试剂,轻轻摇动,排气,盖好瓶塞,振摇3 min后静置分层,重复萃取3次。合并有机相,用水洗至中性,弃去水相,有机相通过无水硫酸钠去除水分,转入旋转蒸发瓶,40 ℃减压浓缩,近干。氮气吹干,用5.00 mL二氯甲烷定容,经0.45 μm膜过滤后上机检测。
1.3 提取条件的优化
(1)不同萃取剂、温度、萃取次数对β-胡萝卜素含量的影响。由同一人员,同一批次样品,同一仪器,按1.2.2进行样品预处理,上机检测,分别考察不同萃取剂[石油醚(沸点:30~60 ℃)、石油醚(沸点:60~90 ℃)、石油醚-丙酮(体积比为1∶1)、丙酮、正己烷和二氯甲烷]、不同提取温度(25 ℃、40 ℃、55 ℃和70 ℃)、不同萃取次数(1次、2次、3次、4次和5次)对β-胡萝卜素含量的影响。
(2)不同浓度的氢氧化钾溶液对β-胡萝卜素含量的影响。按1.2.3进行样品预处理,上机检测,考察不同氢氧化钾溶液浓度(0%、10%、30%、50%和70%)对β-胡萝卜素含量的影响。
1.4 液相色谱条件
色谱柱:ZORBAX SB-C18液相色谱柱(150 mm×4.6 mm,5 μm),美国 Agilent;流动相:三氯甲烷∶乙腈∶甲醇=3∶12∶85,含抗坏血酸0.4 g·L-1,经0.45 μm膜过滤后备用;流速:2.0 mL·min-1;检测波长:450 nm;柱温:35 ℃±1 ℃;进样体积:10 μL。
2 结果与分析
2.1 提取条件优化
2.1.1 萃取试剂的选择
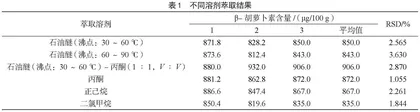
β-胡萝卜素是类胡萝卜素之一,属于脂溶性维生素,易溶于石油醚、正己烷、二氯甲烷等有机溶剂。由表1可知,石油醚-丙酮(1∶1,V∶V)对样品中β-胡萝卜素的提取效率最高,相对标准偏差(Relative Standard Deviation,RSD)也较小。
2.1.2 提取温度选择
由表2可知,试样中的β-胡萝卜素含量随着温度的升高而降低,当温度为25 ℃时,萃取效果最佳,因此选择25 ℃为实验提取温度。
2.1.3 萃取次数的选择
由表3可知,与萃取1次相比,萃取次数为3次、4次、5次时,试样中β-胡萝卜素的含量明显提升,考虑到实验时间,选择萃取次数为3次进行样品前处理测定。
2.1.4 氢氧化钾溶液浓度的影响
由表4可知,随着氢氧化钾体积分数的增加,试样中β-胡萝卜素的含量会逐渐降低,当添加70%体积分数的氢氧化钾溶液时,胡萝卜素含量大幅下降,而不添加氢氧化钾溶液时,试样中的β-胡萝卜素的含量最高。因此,选择实验过程不添加氢氧化钾溶液,省去皂化步骤。
2.2 两种不同前处理方法对β-胡萝卜素检测结果的影响
分别采用1.2.2(省去皂化步骤)与1.2.3(包含皂化步骤)进行样品前处理,选用相同萃取溶剂(石油醚-丙酮体积比为1∶1),对固体饮料、压片糖果和软糖进行检测。由表5可知,两种前处理方法的稳定性均良好,RSD均小于5%。虽然添加了抗坏血酸,但皂化的强碱性条件和55 ℃的皂化温度使抗坏血酸加速氧化,抗氧化能力降低,从而造成皂化的检测结果与回收率均低于不皂化的检测结果。因此,针对固体饮料、压片糖果、软糖等类型β-胡萝卜素主要来源于食品添加剂的样品,不皂化的前处理方式优于现行标准中的皂化处理方式。
2.3 检测方法建立
2.3.1 标准曲线的线性及线性范围
以β-胡萝卜素标液浓度(x)作为横坐标,以峰面积(y)作为纵坐标绘制标准曲线,回归方程为y=1.000 1x-0.080 6,相关系数为0.999 5,结果表明β-胡萝卜素在0.5~10.0 μg·mL-1时,线性关系良好。
2.3.2 方法精密度实验
采用1.2.2步骤前处理方式处理样品,平行测定6次,结果见表6。平行测定结果RSD均符合《合格评定 化学分析方法确认和验证指南》(GB/T 27417—2017)中的精密度要求,表明方法精密度良好。
2.3.3 方法准确度实验
根据样品中β-胡萝卜素的含量,按0.5倍、1.0倍和2.0倍的量加入β-胡萝卜素标准溶液,采用不皂化前处理方法平行测定6次,计算回收率。回收率结果见表7,结果显示β-胡萝卜素的平均加标回收率在91.9%~99.3%,相对标准偏差在1.14%~3.59%,满足《合格评定 化学分析方法确认和验证指南》(GB/T 27417—2017)中的对方法回收率偏差范围的要求,说明方法的准确度良好。
3 结论
对于β-胡萝卜素以游离态存在的样品,如固体饮料、糖果等,皂化处理不仅会造成样品中β-胡萝卜素含量的损失,还会延长实验时间。本文考察了不同萃取剂、不同提取温度、不同氢氧化钾浓度、不同萃取次数对测试样品中β-胡萝卜素的影响,确定了加水分散溶解、石油醚-丙酮(体积比为1∶1)萃取、水洗、浓缩后复溶用高效液相色谱法测定β-胡萝卜素的含量的方法,该方法样品加标平均回收率在91.9%~99.3%,相对标准偏差在1.14%~3.59%。该方法相较于现行国家标准《食品安全国家标准 食品中胡萝卜素的测定》(GB 5009.83—2016),更快速简便,提取效率高,结果更加准确可靠,可用于固体饮料、糖果中β-胡萝卜素的检测。