绿原酸的抗氧化作用与机理研究
作者: 黄平情
摘 要:目的:探讨绿原酸对氧化损伤细胞的改善作用及相关机制。方法:采用2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis-2-methyl-propanimidamide,AAPH)诱导体外培养的人胚肾细胞建立氧化损伤模型,并给予绿原酸进行干预,测定细胞中谷胱甘肽过氧化物酶活力、丙二醛含量、超氧化物歧化酶活性等抗氧化指标以及氧化损伤相关通路蛋白的表达。结果:绿原酸可降低活性氧水平和丙二醛含量(p<0.05),提高谷胱甘肽含量、谷胱甘肽过氧化物酶活力、过氧化氢酶活力以及超氧化物歧化酶活性(p<0.05),可通过调控Kelch样环氧氯丙烷相关蛋白1/血红素氧合酶1(Kelch-like ECH-associated protein 1 / Heme Oxygenase 1,Keap1/HO-1)通路以及降低NADPH氧化酶4(NADPH Oxidase 4,NOX4)的水平(p<0.05)来改善细胞氧化损伤情况。结论:绿原酸的抗氧化机理可能与通过对Keap1/HO-1通路和NOX4蛋白的调控相关。
关键词:绿原酸;抗氧化;蛋白免疫印记;Kelch样环氧氯丙烷相关蛋白1/血红素氧合酶1(Keap1/HO-1)通路;NADPH氧化酶4(NOX4)
Study on Antioxidative Effect and Mechanism of
Chlorogenic Acid
Abstract: Objective: To study the effect of improvement and related mechanism of chlorogenic acid on oxidation-damaged cells. Method: Human embryonic kidney 293 cells (HEK293 cells) cultured in vitro were induced by 2,2’-azobis-2-methyl-prolimidamide (AAPH) to establish the oxidative damage model, and chlorogenic acid was given to intervention. Antioxidant indexes such as glutathione peroxidase activity, malondialdehyde content, superoxide dismutase activity and the expression of oxidative damage related pathway proteins in the cells were determined. Result: Reactive oxygen species levels and malondialdehyde content were reduced by chlorogenic acid (p<0.05). Glutathione content, glutathione peroxidase activity, catalase activity and superoxide dismutase activity were incerased by chlorogenic acid (p<0.05). And chlorogenic acid can improve cellular oxidative damage by regulating the Kelch-like ECH-associated protein 1/heme oxygenase 1 (Keap1/HO-1) pathway and reducing the expression of NADPH oxidase 4 (NOX4) (p<0.05). Conclusion: The antioxidant mechanism of chlorogenic acid may be related to its regulation of the Keap1/HO-1 pathway and NOX4 protein.
Keywords: chlorogenic acid; antioxidant; western blot; Kelch-like ECH-associated protein 1 / heme oxygenase 1 (Keap1/HO-1) pathway; NADPH oxidase 4 (NOX4)
“药食同源”最早由《黄帝内经》提出,指既可作为药物又可作为食物的一类物质,因其具有特定的药用属性,可以预防多种疾病,如富含抗氧剂的食品可以降低某些癌症和心血管疾病的风险;某些食物还可以作为辅助治疗手段,如山楂、生姜。《中华人民共和国食品安全法》指出,生产经营的食品中不得添加药品,但是允许添加既是食品又是中药材的物质,使相关产品在满足原有功能的基础上,增添保健功效。我国《既是食品又是中药材名单》从最初的33种发展至如今的102种[1],人们对药食同源资源的市场需求在不断增长,其研究与开发成果逐渐显现,“中医馆”“国潮茶饮”等新的养生方式深受大众追捧。随着健康中国战略的持续推进,《“健康中国2030”规划纲要》等指导性政策的出台,不仅为健康产业的规范、快速、可持续发展提供了有力的支撑,也为药食同源类产品的研究与开发带来了更大的机遇。
许多慢性变性疾病的病因,包括身体相关炎症、糖尿病及癌症,都与氧化应激有关[2-3]。氧化应激是由细胞中氧化和抗氧化活动之间的失衡引起的,伴随着氧化还原通路破坏和大分子损伤[4]。病理性氧化应激能产生大量的氧化中间物,如活性氧(Reactive Oxygen Species,ROS)、活性氮自由基等。正常细胞中有较低浓度的ROS,能够传递细胞信号和维持稳态,当ROS水平升高,可导致诸多慢性变性疾病的发生,并对生物大分子造成严重损害。
绿原酸是金银花、菊花、杜仲叶、蒲公英等多种药食同源类植物资源的活性成分,在保健食品方面,《保健食品中绿原酸的测定》(GB/T 22250—2008)公布了绿原酸的检测方法。绿原酸类物质是由奎尼酸的羟基和反式苯基丙烯酸的羧基缩合形成的酯,是一种天然的抗氧化剂,研究发现绿原酸可通过降低ROS水平,上调抗氧化酶活性进而降低或阻止氧化应激的发生[5-6]。此外,绿原酸具有多种生物活性,如抗炎、抗菌、降血脂、调节血糖、抗疲劳、抗肿瘤、改善皮肤状态等,被誉为植物黄金[7-11]。因膳食抗氧化剂具有预防氧化损伤和遏制慢性疾病发展的功效[12],本研究拟利用绿原酸的抗氧化活性来验证其作为养生类食品或者保健品成分的优势,并探索绿原酸发挥抗氧化作用的机理。
人胚肾(Human Embryonic Kidney 293,HEK293)细胞是原代人胚肾细胞转染5型腺病毒DNA的永生化细胞,相比肿瘤细胞,其代谢条件更接近正常人体细胞,因此更能真实地模拟人体氧化应激状态[13]。2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis-2-methyl-propanimidamide,AAPH)常用于构建体外细胞氧化损伤模型,诱导细胞产生过量的ROS,导致细胞内DNA、线粒体、蛋白质和脂质发生氧化损伤,最终引起细胞自噬、坏死和凋亡[14]。
基于上述原因,本文采用HEK293细胞为模型细胞、AAPH为氧化损伤诱导剂,构建HEK293细胞氧化损伤模型,并通过检测细胞抗氧化指标及蛋白通路的表达来验证绿原酸改善细胞氧化损伤情况的能力,为绿原酸在养生类食品或保健品中的应用研究与开发提供理论基础。
1 材料与方法
1.1 细胞与试剂
HEK293细胞:国家生物医学实验细胞资源库。
AAPH:美国Sigma公司;绿原酸(纯度99.3%):中国食品药品检定研究院;增强型细胞活力(Cell Counting Kit-8,CCK8)检测试剂盒、二辛可宁酸(Bicinchoninic Acid,BCA)蛋白浓度测定试剂盒、乳酸脱氢酶细胞毒性检测试剂盒、总超氧化物歧化酶(Superoxide Dismutase,SOD)活性检测试剂盒、还原型谷胱甘肽(Reduced Glutathione,GSH)和氧化型谷胱甘肽(Oxidized Glutathione Disulfide,GSSG)检测试剂盒、ROS检测试剂盒、蛋白酶磷酸酶抑制剂混合物:碧云天生物科技有限公司;过氧化氢酶(Catalase,CAT)测定试剂盒、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)测定试剂盒、丙二醛(Malondialdehyde,MDA)检测试剂盒:南京建成生物工程研究所;NADPH氧化酶4抗体(anti-NADPH Oxidase 4,anti-NOX4):英国Abcam公司;聚偏二氟乙烯膜(Polyvinylidene Fluoride,PVDF)、Gibco胎牛血清(Fetal Bovine Serum,FBS):Thermo Fisher Scientific公司;增强型化学发光(Enhanced Chemiluminescence,ECL)法显色试剂盒:武汉塞维尔生物科技有限公司;无水乙醇、氢氧化钠、浓盐酸、磷酸二氢钾、磷酸氢二钠、过硫酸钾、醋酸钠(均为分析纯):北京化学试剂公司。
1.2 仪器与设备
CO2细胞培养箱(BB15):Thermo Fisher Scientific公司;超净工作台(THM#51013522):Thermo Fisher Scientific公司;紫外可见分光光度计(UV-1780):日本SHIMADZU公司;凝胶成像仪(4200SF):上海天能科技有限公司;数显恒温水浴锅(HH-4):普瑞斯机械有限公司。
1.3 方法
1.3.1 细胞培养
HEK293细胞在37 ℃、5% CO2的环境下,用细胞完全培养基[89%DMEM(高糖)+10%FBS+1%双抗]孵育。
1.3.2 氧化损伤模型的建立与绿原酸浓度选择
将HEK293细胞以1×104个/孔的密度接种至96孔板内,放入细胞培养箱孵化24 h后,分为模型组(各加入浓度为0.1 mmol·L-1、0.2 mmol·L-1、0.3 mmol·L-1、0.5 mmol·L-1、0.8 mmol·L-1、1.0 mmol·L-1 AAPH,n=6)和绿原酸组(各加入浓度为10 μg·mL-1、20 μg·mL-1、40 μg·mL-1、80 μg·mL-1、100 μg·mL-1、200 μg·mL-1、400 μg·mL-1绿原酸,n=6)。处理24 h后,通过CCK8试验检测细胞活力,确定AAPH和绿原酸的适宜实验浓度范围。在此基础上,通过ROS试剂盒和乳酸脱氢酶细胞毒性检测试验确定AAPH和绿原酸的最优实验浓度。
1.3.3 细胞分组及培养
对HEK293细胞进行传代培养,分为空白组、模型组及绿原酸组。每孔移取2 mL HEK293(1×105个/孔)细胞悬液置于6孔板内,每组2个复孔,细胞培养箱中培养24 h。弃去培养液,空白组加2 mL完全培养基,模型组和绿原酸组加完全培养基配制的最优浓度AAPH溶液各2 mL。置于细胞培养箱中孵育1 d后,空白组和模型组各加入2 mL完全培养基以替换掉原培养液,绿原酸组加入2 mL完全培养基配制的最优浓度绿原酸溶液以替换掉原培养液。培养箱中培养1 d,弃去培养液,加入200 µL RIPA裂解液裂解细胞,收集细胞裂解液用于后续试验。
1.3.4 抗氧化指标检测
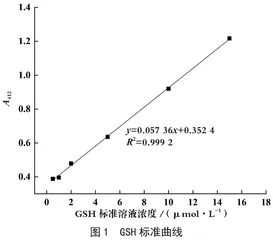
(1)GSH含量测定。使用GSH和GSSG检测试剂盒测定细胞裂解液样品中的GSH浓度。将样品以10 000 r·min-1离心5 min。于96孔板内加入上清液0.01 mL,每孔加入0.15 mL GSH检测工作液,室温孵育5 min,加还原型辅酶Ⅱ溶液50 µL。(25±5)℃反应25 min,检测412 nm处吸光度。制备系列浓度的GSH标准溶液,以吸光度对浓度作线性回归,得标准曲线方程,如图1,根据标准曲线方程计算样品中GSH浓度。