肉制品中大肠埃希氏菌O157:H7实时荧光PCR检测方法的研究
作者: 杨滴
摘 要:以大肠埃希氏菌O157:H7菌体抗原基因rfbE基因为靶标,设计特异性引物和探针,建立大肠埃希氏菌O157:H7实时荧光PCR检测方法。对方法的特异性与灵敏性研究,并选取市售的10种肉类制品验证方法可行性。实验结果表明该方法具有良好的特异性和灵敏性,具有很好的研究价值和应用
前景。
关键词:大肠埃希氏菌O157:H7;实时荧光PCR;检测
Detection of Escherichia coli O157:H7 by Fluorescence Real-Time PCR Method in meats
YANG Di
(Dalian Center of Inspection and Testing Certification Technical Service, Dalian 116600, China)
Abstract: A fluorescence real-time PCR method was developed to detect the Escherichia coli O157:H7. Species-specific primers and probe were designed according to the conserved sequence of rfbE gene of Escherichia coli O157:H7. The specificity and sensitivity of the method were studied, and 10 meat products were selected to verify the feasibility of the method. The results showed this method has good specificity and sensitivity, and this method is valuable for research and application prospects.
Keywords: Escherichia coli O157:H7; fluorescence real-time PCR; detection
大肠埃希氏菌O157:H7(E. coli O157:H7)是肠出血型大肠埃希氏菌的一种主要血清型,是一种危害严重的食源性病原微生物,其广泛分布于自然界,严重威胁公众健康[1-3]。近年来,由致病性微生物引起的食品污染事件呈上升趋势。肉及肉制品营养丰富,可满足人们的需求,但极易滋生各类有害细菌[4]。相关调查发现,肉及肉制品受致病菌的污染最为严重,而E.coli O157:H7污染占比很大[5]。
现阶段E. coli O157:H7的主要检验方法为微生物分离培养鉴定,其过程烦琐、费时费力、易产生假阳性[6]。基于TaqMan探针的实时荧光PCR技术是微生物检验的主要辅助手段,具有高效、特异、精准的优点。本研究旨在以E. coli O157:H7菌体抗原基因rfbE为对象,研发一种肉制品中E. coli O157:H7实时PCR检测方法,为肉制品中E. coli O157:H7的检测提供技术支持,为市场监管提供保障。
1 材料与方法
1.1 菌株
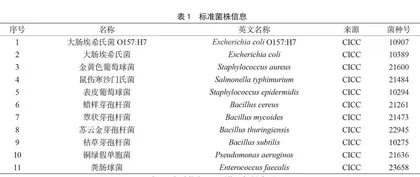
本研究使用11株标准菌株,均购于CICC。所有标准菌株信息见表1。
1.2 主要试剂
营养肉汤培养基;细菌基因组DNA提取试剂盒;Premix Ex Taq PCR试剂盒。
1.3 主要仪器
ABI QS7 Flex荧光定量PCR仪;超低温离心机;DNA分析仪。
1.4 实验方法
1.4.1 引物与探针
根据E. coli O157:H7菌体抗原基因rfbE序列,使用Primer express 3.0软件设计特异性引物和TaqMan MGB探针,引物探针由上海生工公司合成,引物及探针序列见表2。
1.4.2 DNA模板制备
将E. coli O157:H7和其他10株标准菌株接种于营养肉汤培养基,36 ℃培养24 h。取100 μL增菌液,提取DNA作为实时荧光PCR模板。
1.4.3 实时PCR的反应体系及条件
实时荧光PCR扩增采用20 μL反应体系,具体各种试剂浓度、体积见表3。
实时荧光PCR反应程序参考试剂盒说明书为95 ℃预变性30 s,然后进入循环反应,即95 ℃变性5 s、60 ℃退火和延伸30 s,共40个循环。
1.4.4 特异性研究
将E. coli O157:H7等11株标准菌株按照1.4.2制备DNA模板,并用无菌水作为无模板对照,实时荧光PCR反应体系和条件按优化结果设置,验证实时荧光PCR检测E. coli O157:H7的特异性。
1.4.5 灵敏性研究
将E. coli O157:H7标准菌株增菌液进行倍比梯度稀释,形成梯度含菌量为1×106 CFU·mL-1至
1×101 CFU·mL-1的6个浓度的菌悬液。每个稀释度取1 mL菌悬液,按照1.4.2制备DNA,探讨实时荧光PCR检测E. coli O157:H7的灵敏性。
1.4.6 实际样品检测
选取市售鲜猪肉、鲜牛肉、鲜羊肉、鸡胸肉、烤鸭、熟猪头肉、酱牛肉、牛肉干、酱猪耳和酱牛蹄筋共10个样品,分别取上述样品25 g放入装有225 mL营养肉汤的培养基中,于36 ℃培养箱培养24 h。取增菌液1 mL提取DNA后,进行实时PCR反应,探讨本研究的实用性。
2 结果与分析
2.1 特异性结果
本试验以CICC 10907 E. coli O157:H7为目标菌株,以金黄色葡萄球菌、鼠伤寒沙门氏菌等10株标准菌株为非目标菌株,高纯水为无模板对照,验证实时荧光PCR法检测大肠埃希氏菌O157:H7的特异性。扩增结果见图1,只有目标菌株具有扩增曲线,其他10株非目标菌株无扩增曲线。结果表明,本研究建立的实时荧光PCR检测法具有较强的特异性。
2.2 灵敏性结果
分别吸取1×106 CFU·mL-1、1×105 CFU·mL-1、1×104 CFU·mL-1、1×103 CFU·mL-1、1×102 CFU·mL-1和1×101 CFU·mL-1的E. coli O157:H7菌悬液1 mL进行DNA提取,提取的DNA进行实时荧光PCR试验。
E. coli O157:H7灵敏性试验结果见图2。结果显示,大肠埃希氏菌O157:H7浓度为1×106 CFU·mL-1、1×105 CFU·mL-1、1×104 CFU·mL-1、1×103 CFU·mL-1、1×102 CFU·mL-1时均有扩增曲线浓度低于1×102 CFU·mL-1时无扩增曲线,该方法检测的低限为1×102 CFU·mL-1。
2.3 实际样品检测结果
对鲜猪肉、鲜牛肉、鲜羊肉、鸡胸肉、烤鸭、熟猪头肉、酱牛肉、牛肉干、酱猪耳、酱牛蹄筋共10个样品的营养肉汤增菌液进行DNA提取,以大肠埃希氏菌O157:H7为阳性对照,进行实时荧光PCR试验,扩增结果见图3。结果显示,鲜猪肉、鲜牛肉、鲜羊肉中检测出含有E. coli O157:H7。
3 结论与讨论
研发一种灵敏度高、特异性强的快速检测技术已经成为当今社会中肉与肉制品安全监测发展的必然趋势[7]。长期以来,肉制品中大肠埃希氏菌O157:H7检测主要依据细菌培养、生化鉴定,该方法步骤烦琐,且耗时长。实时荧光PCR技术具有灵敏度高、重复性好、反应高效、准确性高、检测周期短等优点[8],已广泛应用于分子生物学和医学研究等领域[9]。本研究以rfbE基因为目标基因,通过反复摸索,建立了一种特异性强、灵敏性高、切实可行的检测肉制品中大肠埃希氏菌O157:H7的实时荧光PCR方法。本研究设计含有不同浓度的大肠埃希氏菌O157:H7(1×106 CFU·mL-1、1×105 CFU·mL-1、1×104 CFU·mL-1、1×103 CFU·mL-1和1×102 CFU·mL-1)菌液样品,试验得到该检测方法的低限为1×102 CFU·mL-1。本检测方法具有特异、快速的特点,能够满足检测要求,为肉制品中大肠埃希氏菌O157:H7的快速检测奠定了基础。
参考文献
[1]ZHAO S H,ZHOU Y,WANG C H,et al.The N-terminal domain of EspF induces host cell apoptosis after infection with enterohaemorrhagic Escherichia coli O157:H7[J].PLoS One,2013,8(1):55164.
[2]ATEBA C N,MBEWE M.Detection of Escherichia coli O157:H7 virulence genes in isolates from beef, pork, water, human and animal species in the northwest province, South Africa: public health implications[J].Research in Microbiol,2011,162(3):240-248.
[3]王建昌,王金凤,段永生,等.基于内参的大肠埃希氏菌O157:H7实时荧光定量PCR快速检测方法的建立[J].食品科学,2015,36(20):226-231.
[4]牟钰,吴楠.影响肉制品安全的因素与控制措施[J].现代食品,2016(16):22-23.
[5]徐锋,陈冈,王建,等.动物及动物产品中大肠埃希氏菌O157带菌情况的调查[J].上海畜牧兽医通讯,2009(1):29-30.
[6]张婧,王利刚,张磊,等.3种大肠埃希氏菌O157:H7筛检方法的比较[J].食品研究与开发,2017(10):112-115.
[7]肖剑,陈娟丽,张彬彬,等.大肠杆菌O157快速检测板在肉与肉制品检测中的应用[J].食品安全质量检测学报,2017,8(1):331-335.
[8]王立均,许恒毅,熊勇华,等.荧光定量PCR在大肠杆菌O157:H7检测中的应用研究进展[J].食品科学,2013,34(11):358-362.
[9]王培育,周梅.肠出血性O157:H7检测技术进展[J].国际检验医学杂志,2013,34(19):2570-2572.