种曲接种量对酱油制曲及发酵的影响
作者: 黄佳玲 刘建华 刘艳梅 苏燕文
摘 要:以米曲霉3.024为菌种,通过试验考察了不同种曲有效接种量对酱油制曲与发酵的影响。结果表明,种曲有效接种量优选为制曲接种3‰折算后干基孢子数为100亿个/g的种曲,即制曲接种时适宜的种曲使用量W=Z×3‰×100÷S(Z为制曲原料总质量,S为使用的种曲的干基孢子数)。企业大生产中按此方法控制不同培养工艺与不同批次干基孢子数差异大的种曲的接种量,可以确保制曲接种的孢子量相同,从而提升制曲的稳定性与质量。
关键词:种曲接种量;有效接种量;制曲接种量;种曲使用量
Effect of Inoculum Size of Seed Koji on Soy Sauce Koji-Making and the Fermentation
HUANG Jialing, LIU Jianhua*, LIU Yanmei, SU Yanwen
(Guangdong Chubang Food Co., Ltd., Yangjiang 529500, China)
Abstract: The test was using Aspergillus oryzae 3.042 as the strain, the effects of different effective inoculum size of seed koji on the soy sauce koji-making and the fermentation were investigated through experiments, the results showed that the effective inoculum size of seed koji is preferably 3‰ of koji-making raw materials, with a converted the spore number of dry-based of 10 billion/g of seed koji, which is the appropriate dosage of seed koji used during koji-making inoculation W=Z×3‰×100÷S (Z is the total mass of koji-making raw materials, S is the number of dry base spores of the seed koji used). In large-scale production of enterprises, the inoculation amount of seed koji with different differences in the number of dry spores in different culture processes and different batches was controlled according to this method, this ensures that koji-making inoculate the same amount of spores, thereby improving the stability and quality of koji-making.
Keywords: inoculum size of seed koji; effective inoculum size; inoculum size of koji-making; dosage of seed koji
酱油酿造主要包含制曲与发酵两大过程,制曲过程是酱油酿造的重要环节。米曲霉在制曲过程中发挥着重要作用,其分泌产生的各种酶,为酱油发酵的原料分解、物质转化合成奠定了基础[1]。酱油制曲过程中蒸料时间、米曲霉接种量、制曲温度、制曲时间对成曲品质指标(蛋白酶比活力、谷氨酰胺酶比活力)均具有影响,其中接种量对蛋白酶比活力的影响最大[2]。酱油制曲用的米曲霉一般是由其母种经过3~4代扩大培养而来,统称为种曲。种曲是酱油生产制曲的种子,种曲制作的主要目的是为酱油生产提供大量种子,即孢子[3]。但不同菌株产孢子能力不同,即使使用相同菌株培养所得的种曲,其孢子数也有很大不同[4]。实际生产中,为便于生产操作控制落实,制曲过程接入种曲时,往往是以培养种曲用的对应干物料的重量计算种曲重量,此时接入的种曲量虽相同,但不同培养工艺培养所得种曲本身的干基孢子数仍存在较大差异,会导致制曲接入的有效孢子数差异较大,进而可能会导致不同批次间制曲的质量产生较大波动,不利于产品品质的稳定。因此,需要找到制曲过程中种曲(米曲霉孢子)有效接种量的最优控制水平,用以控制生产并提升产品的质量与稳定性。
本文采用不同米曲霉孢子有效接入量进行酱油制曲与发酵,跟踪监测不同时间曲料感官、制曲酶活的高低及不同时间发酵过程中常见理化指标,以期为企业大生产中的种曲接种量的控制提供参考。
1 材料与方法
1.1 菌种与原料
菌种,广东厨邦食品有限公司自培米曲霉三角瓶菌种;制曲与发酵过程所用原材料麸皮、黄豆、小麦、食用盐,均从市场采购。
1.2 仪器与设备
IKA RH磁力搅拌器,广州绿百草科学仪器有限公司;25×16血球计数板,上海求精生化试剂仪器有限公司;E100显微镜,南京江南永新光学有限公司;DHG-9140A电热鼓风干燥箱,上海一恒科学仪器有限公司;KDC-2C型微量凯式定氮仪,上海纤检仪器有限公司;Biochrom 30+全自动氨基酸分析仪,英国柏楉有限公司;200 kg种曲机,江苏华晖环保科技有限公司;发酵池,广东厨邦食品有限公司设计自制;65 m³发酵罐,连云港中复连众复合材料集团有限公司。
1.3 试验方法
1.3.1 种曲培养方法
麸皮原料直接均匀按1.0~1.5 cm的厚度装满曲盘后,放入种曲机;以180~200 mL·min-1的喷水量补湿25~30 min,同步开启种曲机风机;启动种曲机的自动灭菌与冷却功能,自动通入蒸汽升温至120~125 ℃,保压灭菌25~30 min对麸皮培养基进行灭菌,而后自动冷却使培养基的温度降至35~40 ℃;接入(6±2)‰的三角瓶菌种,并同步开启种曲机风机20~30 min,接种完毕;控制加湿喷头的喷水量在270~300 mL·min-1对接种后的培养基加湿(120±5) min,同步开启种曲机风机;通过种曲机的自动培养程序进行自动控温、加湿和通风,同时整个培养过程中种曲机风机需保持一直开启。其中,培养温度为28~36 ℃,通风量为5~7 m³·h-1,以180~200 mL·min-1的喷水量间断性加湿培养至72 h,最终培养获得成熟种曲[5]。
1.3.2 种曲有效接种量对酱油制曲的影响
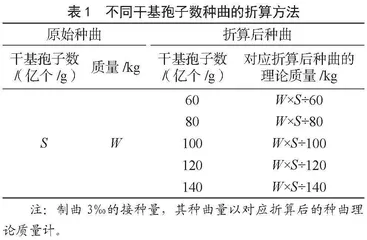
将按1.3.1种曲培养方法培养所得的种曲依据其干基孢子数折算为60亿个/g、80亿个/g、100亿个/g、120亿个/g和140亿个/g不同干基孢子数的种曲(折算方法详见表1),再统一以3‰(W/W)的接种量将折算后种曲接入制曲原料进行大曲培养。其间,培养至第15~16 h进行第一次翻曲,继续培养至第21~24 h进行第二次翻曲,培养至44 h获得成熟大曲[6]。每组试验需记录第一、二次翻曲时曲料与成熟大曲的感官状态,并以其感官、大曲中性蛋白酶活为判定依据,初步确定制曲适宜的种曲有效接种量。
1.3.3 种曲有效接种量对酱油发酵的影响
将1.3.2试验中初步确定的制曲适宜的种曲有效接种量对应组别的成熟大曲分别与2.2倍20%的盐水混合制醪,以相同投料量和投料时间分别投入65 m³发酵罐,参照广式高盐稀态酱油酿造的常规工艺进行发酵。在发酵至10 d、20 d、30 d、60 d、90 d和120 d,分别取其发酵液检测总酸、氨基酸态氮、全氮、还原糖等常规指标进行跟进验证,再结合1.3.2试验结果进一步确认制曲适宜的种曲有效接种量。
1.3.4 在广式高盐稀态酱油酿造工艺中的应用试验
以成熟大曲的感官、中性蛋白酶活及其90 d发酵液氨基酸态氮与全氮为主要指标、90 d发酵液总酸、还原糖为参考指标,验证1.3.2与1.3.3共同确认的种曲有效接种量应用于广式高盐稀态酱油酿造工艺中制曲与发酵的稳定性。按照1.3.1种曲培养方法制备种曲,再按照1.3.2的制曲工艺制备成熟大曲(制曲接种量按照1.3.2与1.3.3共同确认的种曲有效接种量执行),而后按照1.3.3的发酵工艺进行发酵,发酵至120 d取其发酵液进行检测。上述试验共开展10批次平行试验,以验证其在大生产中的稳定性。
1.3.5 数据测定方法
孢子数测定参照《孢子数测定法》(SB/T 10315—1999)[7];中性蛋白酶活测定参照《蛋白酶活力测定》(SB/T 10317—1999)[8];总酸含量参照《食品安全国家标准 食品中总酸的测定》(GB 12456—2021)[9],采用第三法自动电位滴定法测定;氨基酸态氮含量测定参照《食品安全国家标准 食品中氨基酸态氮的测定》(GB 5009.235—2016)[10];还原糖含量参照《食品安全国家标准 食品中还原糖的测定》(GB 5009.7—2016)[11],采用直接滴定法测定。
2 结果与分析
2.1 种曲有效接种量对酱油制曲的影响
米曲霉的接种量对酱油制曲的质量,特别是其关键指标蛋白酶活有一定影响。在大生产中,制曲接入的种曲量相对固定,但当种曲的孢子数不同时,其不同批次有效米曲霉孢子接入量亦不相同,可能会对制曲质量产生影响。试验通过将种曲折算为不同干基孢子数的种曲,再按统一的接种量制曲(实际接入的有效孢子数不同),从而验证确定制曲适宜的种曲有效接种量,试验结果见表2。
由表2可知,随着制曲接种的折算后种曲干基孢子数的升高,米曲霉的生长速度逐步加快,开始产生孢子的时间亦有所提前,成熟大曲的孢子量明显上升。当制曲接种的折算后种曲干基孢子数达到140亿个/g时,米曲霉生长速度最快,在第二次翻曲时曲料的孢子量已到达生产可接受水平的上限,而成熟大曲感官孢子丰满、孢子量远超出生产可接受水平;当制曲接种的折算后种曲干基孢子数在120亿个/g及以下时,成曲孢子量最多为3个+的水平,均处于生产可接受水平。成熟大曲的中性蛋白酶活则整体呈现先快后慢的上升趋势,在制曲接种的折算后种曲干基孢子数为120亿个/g时,成熟大曲中性蛋白酶活达到最大值(2 757 U·g-1);制曲接种的折算后种曲干基孢子数继续提升至140亿个/g时,成熟大曲中性蛋白酶活为2 682 U·g-1,略有下降。这可能是因为种曲有效接种量过大,会引起品温上升相对较快,易结块,不利于通风供氧,营养物质消耗过快,影响米曲霉的生长代谢,导致产酶量降低。结合生产经验,暂定制曲适宜的种曲有效接种量为接种3‰折算为80~120亿个/g干基孢子数的种曲。
2.2 种曲有效接种量对酱油发酵的影响
分别采用1.3.2试验中制曲接种量为接种3‰折算后干基孢子数为80亿个/g、100亿个/g、120亿个/g的种曲培养所得成熟大曲与盐水混合制醪,而后发酵晒制,并跟进发酵过程中不同天数发酵液的总酸、氨基酸态氮、全氮、还原糖等评价发酵质量优劣的主要指标。
2.2.1 发酵过程总酸的动态变化
由图1酱油发酵过程中总酸的动态变化可以看出,酱油发酵过程中,不同组别总酸含量均是在发酵前90 d快速上升,90 d时基本达到最高水平,而后维持在一个相对稳定的状态。120 d总酸含量有小幅下降,可能是因为某些微生物可以将有机酸转化为其他次级代谢产物[12]。总酸是酱油品鉴的风味物质,且与产品货架期的体态稳定性相关,总酸过低会导致酱油体态不稳定,析出絮状杂质或晶体,且影响酱油防腐效果;总酸过高会导致产品发酸,影响其风味的柔和性,并掩盖发酵酱油本身的酱香味[13]。因此,结合生产经验,种曲有效接种量优选为接种3‰折算为80亿个/g、100亿个/g干基孢子数的种曲。