潮州市售米粉转基因成分的检测与分析
作者: 王茂先 沈林欣 傅若思 曾玲 许丹影
摘要 为进一步了解潮州市售米粉转基因成分的情况,随机购买潮州城区主要市场售卖的米粉进行检测与分析。通过十六烷基三甲基溴化铵(CTAB)法提取所购买的米粉样品的DNA成分,采用常规聚合酶链式反应(PCR)和实时荧光PCR等技术对外源基因CaMV35S、tNOS进行检测。结果表明,有接近50%的检测米粉样品含有转基因成分,且均没有任何转基因食品标识。因此,为了促进米粉等大米制品的生产和销售的规范化,必须高度重视转基因食品标识制度的落实,建立起有效的转基因大米制品的监管体系。
关键词 米粉;转基因成分;外源基因;内源基因
中图分类号 TS 212.7 文献标识码 A 文章编号 0517-6611(2025)02-0206-05
doi:10.3969/j.issn.0517-6611.2025.02.041
开放科学(资源服务)标识码(OSID):
Detection and Analysis of Genetically Modified Ingredients in Rice Noodles in Chaozhou City
WANG Mao-xian, SHEN Lin-xin, FU Ruo-si et al
(School of Life Science and Food Engineering, Hanshan Normal University, Chaozhou,Guangdong 521041)
Abstract To further understand the presence of genetically modified ingredients in rice noodles in Chaozhou City, we randomly purchased rice noodles in major markets in Chaozhou for testing and analysis. The DNA components of the rice flour samples were extracted by the cetyl trimethyl ammonium bromide (CTAB) method, and the exogenous genes CaMV35S and tNOS were detected by conventional polymerase chain reaction (PCR) and real-time fluorescence PCR. The results showed that nearly 50% of the detected rice noodles samples contained genetically modified ingredients, and none of them had any genetically modified food label.Therefore, in order to promote the standardization of the production and sale of rice products, such as rice noodles, it is necessary to attach great importance to the implementation of a labeling system for genetically modified (GM) food products and establish an effective supervision system for GM rice products.
Key words Rice noodle;Genetically modified ingredient;Exogenous genes;Endogenous genes
随着科学技术尤其转基因技术的不断地发展,1996年转基因作物开始商业化生产,转基因农作物种植规模迅速扩大。转基因食品也在不断地出现并深入到公众日常生活的方方面面[1]。由于转基因食品还没有在科学界和公众之间达成统一的共识,转基因食品的安全问题已经成为公众持续关注的焦点。米粉,这里是指以大米为原料,经浸泡、蒸煮、压条等工序制成条状、丝状的米制品,而不是词义上理解的以大米为原料研磨制成的粉状物料。米粉是我国的传统食品,结构柔韧,富有弹性,水煮不糊汤,干炒不易断,配以各种菜码或汤料进行汤煮或干炒,爽滑入味,深受广大消费者的喜爱[2]。对于其食用方法,有研究发现湿米粉品质受大米淀粉凝胶效果的影响[3],其中,不仅涉及糊化程度,更关乎老化效果。
近年来,由于米粉的利润具有很大优势,大量流入我国市场,又因为其种类繁多,人们几乎可以随意给米粉命名,导致其类别混乱[4]。米粉主要的销售对象为个人或者餐饮企业,为了进一步降低成本,或在原料方面把关不合格,部分售卖者购买转基因米粉进行售卖,导致转基因产品大量流入市场[5]。深圳海关在监管过程中发现,出口大米成品中检测出转基因成分,说明我国某些地区在非法销售未经国家批准的转基因水稻种子并有水稻的种植行为,部分转基因水稻及其大米已经流入市场[6]。在各种品牌米粉中不断地被检测出含有未经批准的转基因成分,人们不禁对自己日常生活中所吃米粉的食品安全问题感到担忧。在转基因检测中,常需要检测CaMV35S和tNOS基因。在检测大米制品的转基因成分时,除了检测外源基因,还需要检测内源基因SPS的存在情况,以确保检测结果的准确性与可靠性。此外,转基因大米制品的检测需要先进行高质量DNA提取,对后续研究至关重要。提取方法的灵敏度和特异性也会直接影响后续试验的成功[7-8]。由于大米及大米加工品中存在的大量淀粉、蛋白及其他形式的多糖,有可能对PCR产生抑制作用[9]。为了解潮州市售米粉的转基因情况,该研究对潮州市售米粉进行抽样检验,采用改良十六烷基三甲基溴化铵法(CTAB法)提取米粉基因组DNA,并利用常规聚合酶链式反应(PCR)、实时荧光PCR对米粉样品中的内源基因SPS和外源基因CaMV35S、tNOS进行双重检测,为相关的研究机构提供一定科学依据。
1 材料与方法
1.1 试验材料
1.1.1 样品。
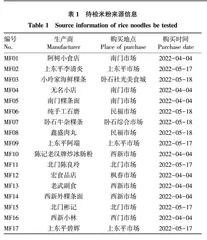
此次试验所采集的样品来自潮州城区的枫春市场、南门市场、北门市场、西门市场、民福市场、上东平市场、卧石社光美食城、卧石综合市场、西新市场共9个主要市场市售的米粉。米粉待检样品来源情况如表1所示。
1.1.2 试剂和试剂盒。
Dzup柱式深加工产品基因组DNA抽提试剂盒,SGExcel Fast SYBR qPCR预混液,Taq PCR Mix预混液(2×,含DNA染料),核糖核酸酶A溶液,Proteinase K,DNA分子量标准Marker(25~500 bp、100~10 000 bp),50×TAE缓冲液,4S Green核酸染色剂,3对上下游引物(SPS r/f、CaMV35S r/f、tNOS r/f),琼脂糖,以上均购自生工生物(上海)工程股份有限公司。
1.1.3 仪器与设备。实时荧光PCR仪器Light Cycler 96(瑞士Hoffmann-La Roche有限责任公司);Bio-Rad凝胶成像系统(美国Bio-Rad Laboratories,Inc.);水平电泳仪(北京六一生物科技有限公司);B-500型超微量紫外可见分光光度计(上海元析仪器公司);台式高速冷冻离心机(济南福的机械有限公司);恒温水浴锅(江苏科析仪器有限公司);常温冰箱(青岛Haier公司)。
1.2 试验方法
1.2.1 米粉基因组DNA提取。
1.2.1.1
样品预处理。采用湿的、细的米粉,对于干的米粉可采用试验前冷水浸泡30~60 min,浸泡的水同样也倒进离心管中进行提取。取足量的米粉切碎并称取200 mg的食品粉末至2 mL离心管中,每次切完一个样品后,需对刀片进行清洗并用干净的纸巾擦干。
1.2.1.2
样品基因组DNA抽提。采用Dzup柱式深加工产品基因组DNA抽提试剂盒,具体步骤详见试剂盒说明书。抽提所得到的DNA溶液置于-20 ℃保存或者直接用于后续试验。
1.2.2 米粉基因组DNA纯度和浓度的测定。
用核酸蛋白分析仪测量OD值,在波长为260和280 nm处对DNA样品的吸光度进行测量。纯度高的DNA样品OD260nm/280nm在1.8左右,当OD260nm/280nm大于1.8时,说明样品中还有部分RNA残留;若OD260nm/280nm小于1.7,则表明样品中受到酚或蛋白质的污染。倘若OD260nm/280nm为1.8~2.0,DNA质量浓度达到5~80 ng/μL,则基本能够进行后续的PCR检测。为了后续试验顺利进行,通过基因组DNA凝胶电泳,检测所提取的基因组DNA的质量是否可用于后续的PCR检测。
1.2.3 常规PCR检测和琼脂糖凝胶电泳分析。
将已提取到的米粉基因组DNA进行常规PCR检测。分别对内源基因SPS和外源基因CaMV35S、tNOS进行扩增。常规PCR扩增体系(25 μL):上游引物1.0 μL、下游引物1.0 μL、基因组10.5 μL、Taq PCR Mix预混液12.5 μL。引物序列和反应循环参数如表2所示。
琼脂糖凝胶电泳分析:完成PCR扩增后,使用1×TAE电泳缓冲液和琼脂糖制备3%的琼脂糖凝胶(等凝胶融化后冷却到约60 ℃左右时,加入4S Green核酸染色剂)。将10 μL PCR扩增产物分别加入对应的凝胶孔中,再同时于凝胶孔中加入2.5 μL DNA分子量标准Marker(25~500 bp),凝胶电泳的电压为90 V,时间为45 min。用凝胶成像分析系统进行观察分析并记录结果。其中SPS目的基因片段为104 bp,CaMV35S目的基因片段为82 bp,tNOS目的基因片段为165 bp。
1.2.4 实时荧光PCR检测。
将提取到的米粉基因组DNA进行实时荧光PCR反应。首先分别对内源基因SPS和外源基因CaMV35S、tNOS进行扩增。实时荧光PCR反应体系(20 μL):基因组6 μL、上游引物1 μL、下游引物1 μL、SGExcel Fast SYBR qPCR预混液10 μL,最后再用dd H2O根据DNA模板量变化补至20 μL。空白对照以超纯水代替模板DNA。
1.3 数据处理
试验数据以实测有效数值来表示,且均采用相关分析仪器进行记录处理,对不同样本的实测有效数值进行归一化处理后进行分析。
2 结果与分析
2.1 米粉基因组DNA的OD260 nm/280 nm及其浓度的测定
此次试验的检测样品来自市场及其周边的店铺,由于米粉有粗有细,有干有湿,以及米粉属于加工产品,在制作过程中(研磨、蒸煮等方式)对于样品的处理可能已经使得部分基因断裂。前期试验中对于提取米粉中DNA的方法多次进行尝试探索,例如,将米粉样品于65 ℃水浴加热10 min后用研钵研磨,然而得出的核酸浓度为负值;提前一晚浸泡米粉,浸泡时间过长,抽提的核酸浓度也较低。
经过不断改良摸索得出以下的操作注意事项:首先,在试验前处理样品要尽量用刀切碎,而不用加热、研磨等方法处理,防止基因进一步断裂;其次,使用较为湿润的米粉样品进行提取且米粉样品要切得尽量碎,而且试验结果也表明细的米粉提取出来的DNA浓度较高。而干米粉以及较粗的米粉基因组DNA可能在加工过程中耗损较大,因此在提取过程可以适当延长水浴时间,由原本的0.5 h延长至1.0 h左右较为适宜。同时,在整个过程中一定要严格遵循试验方法中提高DNA得率的措施。
由表3可知,样品中基因组DNA均已成功提取,OD260 nm/280 nm为1.7~2.0,说明样品中还有RNA没有除尽,依旧有RNA残留,但影响较小可忽略不计,且DNA质量浓度为5~80 ng/μL,基本能够进行后续的PCR检测。