丁香酚对合果芋果胶杆菌(Pectobacterium aroidearum)L6抑菌效果研究
作者: 禄锦鹏 刘文波 范鸿雁 缪卫国 林春花 秦春秀
摘要 以实验室前期分离的果胶杆菌(P.aroidearum)L6为对象,探究丁香酚对其抑菌效果。通过常量稀释法测定丁香酚对合果芋果胶杆菌(P.aroidearum)L6的抑菌活性;利用紫外分光光度法测定经丁香酚处理后菌液的K+、AKP、ATP、核酸和蛋白质含量;测定其电导率,再利用扫描电子显微镜观察经丁香酚处理后的菌体,从细胞水平探究丁香酚抑菌效果。结果显示,丁香酚对合果芋果胶杆菌(P.aroidearum)L6的MIC为800 mg/L,EC 50为409.33 mg/L;通过对比丁香酚处理前后的菌体破坏特征,发现K+、AKP、核酸、蛋白质和电导率上升,ATP水平下降;扫描电子显微镜观察显示,丁香酚处理的菌体出现裂解、黏连现象。丁香酚通过破坏果胶杆菌(P.aroidearum)L6细胞膜完整性,引起内含物泄露、能量代谢失衡,从而达到抑菌作用。
关键词 丁香酚;果胶杆菌;抑菌作用;细胞膜
中图分类号 S 482.2 文献标识码 A 文章编号 0517-6611(2025)04-0124-05
doi:10.3969/j.issn.0517-6611.2025.04.025
开放科学(资源服务)标识码(OSID):
Antibacterial Effect of Eugenol on Pectobacterium aroidearum L6
LU Jin peng1,LIU Wen bo1, FAN Hong yan2 et al
(1.Tropical Agriculture and Forestry Colloege,Hainan University/Key Laboratory of Green Prevention and Control of Tropical Plant Diseases and Pests,Ministry of Education,Haikou,Hainan 570228;
2.Institution of Tropical Fruit Trees,Hainan Academy of Agricultural Sciences,Haikou,Hainan 571199)
Abstract The study investigated the antibacterial effect of eugenol against P.aroidearum L6,which was isolated in the laboratory.The antibacterial activity of eugenol was determined using the constant dilution method.Ultraviolet spectrophotometry was used to measure the levels of K+,AKP,ATP,nucleic acid,and protein in the bacterial solution treated with eugenol.The electric conductivity was measured.Scanning electron microscopy was used to observe eugenol treated bacteria and explore the antibacterial effect at the cellular level.The MIC of eugenol for P.aroidearum L6 was 800 mg/L.And the EC 50 of eugenol for P.aroidearum L6 was 409.33 mg/L.Comparison of bacterial damage characteristics before and after eugenol treatment revealed increased levels of K+,AKP,nucleic acid,protein,electric conductivity and decreased ATP levels.Scanning electron microscopy images showed lysed and adhered bacteria following eugenol treatment.Eugenol disrupts the integrity of the cell membrane of P.aroidearum L6,causing leakage of intracellular contents and an imbalance in energy metabolism,thereby achieving its antibacterial effect.
Key words Eugenol;Pectobacterium aroidearum;Antibacterial effect;Cell membrane
基金项目 海南省自然科学基金项目(322MS025,321RC470);海南省院士创新平台科研专项(YSPTZX202018)。
作者简介 禄锦鹏(2003—),男,甘肃兰州人,硕士研究生,研究方向:植物病理。
*通信作者,助理研究员,硕士,从事热带作物病理学研究。
收稿日期 2024-06-24
合果芋(Syngonium podophyllum),也被称为箭叶藤、鹅掌叶、尼芬芋,是天南星科草本常绿植物,原产于中美洲和南美洲的潮湿森林地带[1]。目前,合果芋在观叶植物中使用最为广泛,包括室外园林观赏、室内盆栽或者吊篮装饰等[2-3]。Pectobacterium spp.是细菌性软腐病的主要病原,其寄主范围很广,各个种都可以侵染农作物、水果、观赏植物等造成破坏性的软腐病害[4-5]。实验室前期在合果芋叶片上发现严重的细菌性软腐病,通过室内分离、单孢纯化及致病性测定,并通过形态特征、生理生化特性、16S rNA及DNA-DNA杂交等方法,鉴定引起合果芋软腐病的病原为果胶杆菌(P.aroidearum)[6-7],该病原是许多植物上的致病病原,为害严重,目前还缺少有效药剂防治[8],已有研究利用贝莱斯芽孢杆菌(Bacillus velezensis)BPC16和W2-7对P.aroidearum引起魔芋软腐病进行防治,但防效均未超过45%[9];罗林丽等[10]从13种常见的杀细菌剂中筛选出7种对P.aroidearum有抑菌效果,但其化学农药在田间进行的试验还未见报道,而且化学药剂防治会对环境造成一定程度的污染。因此,寻找新型天然安全的抑菌剂尤为重要。
丁香酚作为一种植物天然的次级代谢产物,因其广谱的抑菌活性和天然安全的特性,是一种天然抑菌剂。2022年发布食品安全国家标准中,丁香酚可作为食品添加剂,是一种稳定安全绿色的药剂,在医疗、食品和微生物抑制等领域受到广泛的关注[11-13]。目前已有众多研究揭示丁香酚对不同病原菌的抑菌机理和抑菌活性[14-21],且已有研究利用新型纳米级星状聚合阳离子材料(StarPolycation,SPc)和丁香酚进行组装,提高递送效率,经 SPc 递送的丁香酚提高了对马铃薯晚疫病的防效[20]。但丁香酚抑制细菌果胶杆菌属的研究较少,尤其在丁香酚对P.aroidearum的抑菌活性和机理上尚未见报道。因此,笔者以前期在合果芋上分离的引起严重细菌性软腐病的合果芋果胶杆菌(P.aroidearum)L6作为研究对象,探究丁香酚对该菌的抑菌效果并测定抑菌活性。采用微量二倍梯度稀释法算出丁香酚对P.aroidearum L6的最小抑菌浓度(Minimal Inhibit Concentration,MIC)为800 mg/L,进一步绘制不同浓度下丁香酚对L6生长曲线,并结合核酸和可溶性蛋白质含量、K+含量、AKP活性、ATP酶活性、胞外相对电导率、扫描电子显微镜观察,揭示丁香酚对P.aroidearum L6的抑菌效果,以期为由P.aroidearum引起的植物软腐病菌的药剂筛选和田间防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株。
2019年7月在海南省海口市美兰区海南大学海甸校区农科实验基地中发现具有严重细菌性软腐病的合果芋叶片,经分离、纯化得到P.aroidearum L6菌株,菌株保存于热带农林生物灾害绿色防控教育部重点实验室。
1.1.2 培养基与试剂。
Luria-Bertani液体培养基(LB),纯度为98.5%丁香酚(上海源叶生物科技有限公司),纯度为99.5%的二甲基亚砜(dimethyl sulfoxide,DMSO)(广州赛国生物科技有限公司),K+离子试剂盒、碱性磷酸酶(alkaline phosphatase,AKP)、三磷酸腺苷(adenosine triphophate,ATP)酶试剂盒(南京建成生物工程研究所),纯度为50%戊二醛(麦克林公司)。
1.1.3 仪器与设备。
小型5417R型冷冻离心机(Eppendorf),组合式ZQZY-CS8E型全温振荡型培养箱(上海知楚),雷磁DDS-11A电导率仪(上海仪电科学仪器股份有限公司),721N型紫外-可见分光光度计(上海仪电科学仪器股份有限公司)。
1.2 试验方法
1.2.1 细菌悬浊液制备。
在LB液体培养基中培养果胶杆菌(P.aroidearum)L6,用LB培养基稀释,使其菌体浓度为107~108 CFU/mL备用。
1.2.2 MIC和EC 50浓度测定。
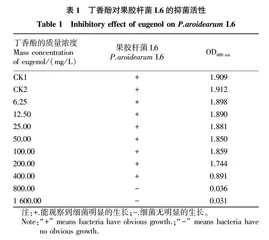
将丁香酚溶于质量分数2.5%的DMSO,采用二倍稀释法[18]配制不同质量浓度的丁香酚,得到终浓度为6.25、12.50、25.00、50.00、100.00、200.00、400.00、800.00、1 600.00 mg/L的丁香酚稀释液,向5 mL无菌离心管中分别加入1.1 mL不同浓度的丁香酚稀释液、1 mL LB培养基和100 μL细菌悬浊液,对照组1加入1.1 mL质量分数2.5% DMSO和100 μL细菌悬浊液,对照组2加入1.1 mL 无菌水和100 μL细菌悬液,在28 ℃下培养24 h,计算最小抑菌浓度MIC和半数有效作用浓度EC 50,重复3次。
1.2.3 可溶性蛋白和核酸含量测定。
参考“1.2.2”方法,1 mL细菌悬浊液中加入终浓度为0(对照)、0.25 MIC、0.50 MIC、1.00 MIC、2.00 MIC的丁香酚稀释液,对照组加入等体积质量分数2.5%的DMSO,在摇床中以180 r/min、28 ℃条件培养5 h 后,8 000 r/min离心15 min,取其上清液测得OD 280 nm和OD 260 nm,以OD 260 nm表示胞外核酸相对量,以OD 280 nm表示胞外可溶性蛋白相对量,重复3次,每次设置3个平行。
1.2.4 K+含量测定。
通过“1.2.3”的方法获得上清液,用K+试剂盒检测上清液中K+含量,重复3次,每次设置3个平行。
1.2.5 碱式磷酸酶(AKP)活力测定。
通过“1.2.3”的方法获得上清液,用AKP试剂盒测定上清液中AKP的活力,重复3次,每次设置3个平行。
1.2.6 ATP酶活力测定。
通过“1.2.3”的方法处理细菌悬浊液,获得上清液和沉淀,将上清液用于胞外可溶性蛋白含量测定,蛋白质定量利用紫外(UV)吸收测定法以牛血清蛋白做标准曲线评估[22]。取离心后沉淀,使用超声波细胞粉碎机于冰浴环境下超声粉碎20 min,用ATP酶试剂盒检测上清液ATP酶活性,重复3次。
1.2.7 电导率测定。
参考“1.2.2”方法和陈梦玲等[23]的方法,并稍加修改,将浓度107~108 CFU/mL的细菌悬浊液中加入终浓度为0(对照)、0.25 MIC、0.50 MIC、1.00 MIC、2.00 MIC的丁香酚稀释液,对照组加入等体积质量分数2.5%的DMSO,在摇床中以180 r/min、28 ℃培养12 h,分别于0、2、4、6、8、10、12 h取培养液测定其电导率,重复3次。