地生弯颈霉C41-3产低温脂肪酶发酵条件优化
作者: 孙蕊 苏丹 张文浩 吕国忠
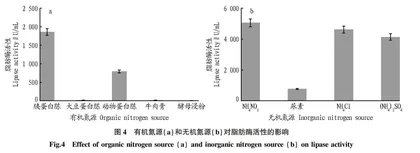
摘要 [目的]优化地生弯颈霉C41-3产低温脂肪酶发酵条件,为扩大低温脂肪酶的应用提供理论依据。[方法]使用棕榈酸对硝基苯酯(p-NPP)比色法测定脂肪酶的活性。[结果]最佳发酵培养基为胰蛋白胨40 g/L、α-乳糖20 g/L、MnSO4·H2O 1 g/L、NH4NO3 1 g/L、乳化芥花油20 mL;最佳发酵条件为pH 5、发酵温度15 ℃、培养时间4 d。优化后,地生弯颈霉C41-3的脂肪酶活性从199.40 U/mL增加至5 700.72 U/mL,脂肪酶活性增加了约27.6倍。[结论]该新型脂肪酶具有潜在的工业应用价值。
关键词 低温脂肪酶;地生弯颈霉C41-3;发酵条件优化
中图分类号 Q949.32 文献标识码 A
文章编号 0517-6611(2024)02-0001-04
doi:10.3969/j.issn.0517-6611.2024.02.001
开放科学(资源服务)标识码(OSID):
Optimization of Fermentation Condition of Cold-activer Lipase Producing by Tolypocladium geodes C41-3
SUN Rui,SU Dan,ZHANG Wen-hao et al
(College of Life Science and Engineering,Shenyang University,Shenyang,Liaoning 110044)
Abstract [Objective]To optimize the fermentation conditions for low-activer lipase production by Tolypocladium geodes C41-3 and provide theoretical basis for expanding the application of low-activer lipase.[Method]The lipase activity was measured by the p-nitrophenyl palmitate (p-NPP) colorimetric method.[Result]Best fermentation medium was tryptone 40 g/L,α-lactose 20 g/L,MnSO4·H2O 1 g/L,NH4NO3 1 g/L,emulsion canola oil 20 mL.Best fermentation condition was pH 5,fermentation temperature of 15 ℃,culture time of 4 days.After optimization,the lipase activity of T.geodes C41-3 could be increased from 199.40 U/mL to 5 700.72 U/mL,and the lipase activity increased by about 28.5 times, [Conclusion]The novel lipase has potential industrial applications value.
Key words Cold-active lipase;Tolypocladium geodes C41-3;Optimization of fermentation conditions
基金项目 国家自然科学基金面上项目(31770025);辽宁省教育厅青年育苗项目(2020JYT02);辽宁省自然科学基金指导计划项目(2019-ZD-0549);大连民族大学生物技术与资源利用教育部重点实验室开放课题(KF2021002)。
作者简介 孙蕊(1995—),女,甘肃庆阳人,硕士研究生,研究方向:微生物。*通信作者,副教授,博士,硕士生导师,从事微生物资源与利用研究。
收稿日期 2022-10-04
脂肪酶是仅次于淀粉酶和蛋白酶的第三大类工业酶[1],它可以分别在脂质-水界面和非水溶性底物界面催化脂质水解和酯的合成[2]。脂肪酶可以逐步将甘油三酯水解成脂肪酸和甘油,这些脂肪酶广泛存在于各种植物、动物和微生物组织中[3]。与动物、植物脂肪酶相比,微生物脂肪酶具有生产周期短、产量高、生产成本低等优点[4-5]。微生物脂肪酶的酶学特性和底物特异性普遍多样,在未来洗涤剂、化妆品等商业市场的发展中具有很大的吸引力[6]。
大多数低温脂肪酶来自低温微生物。低温脂肪酶的最佳活性一般在30~40 ℃,在0~20 ℃仍具有较高的酶活性[7]。低温脂肪酶具有生产成本低、品种多、有机溶剂稳定性好、作用特异性强、反应条件温和、能耗低等优点[8]。因此,低温脂肪酶比在高温下工作的酶具有更经济和生态优势[9]。它们在各种工业应用如皮革加工、医药制剂、精细化学合成、洗涤剂添加剂、食品加工、环境生物修复、生物转化、化妆品制备和异源宿主中的基因表达等方面[10-11]具有真正的酶潜力。低温脂肪酶通常存在于5 ℃以下存活的耐冷和嗜冷微生物中。低温微生物大多来自北极和南极冰川以及其他寒冷地区,它们在(0±2)℃处表现出持续的寒冷栖息地[8]。冷活性微生物可在0~5 ℃的温度下生长和繁殖,最适生长温度为25 ℃或以下,最高生长温度约为30 ℃[12-13]。
地生弯颈霉C41-3是从我国长白山自然保护区的苔原带采集的土壤中分离得到的。地生弯颈霉(Tolypocladium geodes)是具有高海拔分布特征的耐冷真菌[14-15]。地生弯颈霉属于子囊菌门(Ascomycota)、粪壳菌纲(Sordariomycetes)、肉座菌目(Hypocreales)、线虫草科(Ophiocordycipitaceae)、弯颈霉属(Tolypocladium)[16]。弯颈霉属是由Gams在1971年建立的新属,国际真菌名录数据库里截至目前记载的弯颈霉属有43个种[17-18]。弯颈霉属真菌是一类非常重要的虫生真菌,其次级代谢产物也相当丰富,主要有环孢菌素(cyclosporine)、大团囊素(ophiocordin)、线肽素(efrapeptin)、四聚胺酸素(ophiosetin)等,这些代谢产物都具有抗菌杀虫、抗氧化的作用[19]。环孢菌素作为新型免疫抑制剂,在器官移植术后抗排斥反应、自身免疫性疾病、预防农作物病虫害、皮肤病、眼病以及牙槽炎症等临床上的应用逐渐普及。截至目前,国际上不仅只对弯颈霉属真菌次级代谢产物进行报道,也对弯颈霉产生的胞外酶进行研究。 研究表明雪白弯颈霉(Tolypocladium inflatum)、株孢弯颈霉(Tolypocladium cylindrosporum)都是生产脂肪酶的高产菌株,同时两者还能产出几丁质酶[20]。但鲜见地生弯颈霉生产脂肪酶的相关报道。
脂肪酶的高产率对于低温脂肪酶的工业化生产具有重要意义。脂肪酶的产生会受到几个因素的影响,包括培养时间、温度、pH、培养基成分和诱导物的存在,这些因素会影响细胞生长和脂肪酶的产生。因此该试验通过对地生弯颈霉生产低温脂肪酶的影响因素进行优化,为今后更好地利用地生弯颈霉生产低温脂肪酶奠定了基础,也更加证明了弯颈霉属真菌在临床和工业生产方面都有重大的应用前景。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株来源。菌株C41-3是从我国长白山自然保护区的苔原带采集的土壤中分离得到的。
1.1.2 培养基。PDA培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L,水1 000 mL,pH自然。种子培养基:马铃薯200 g/L,葡萄糖20 g/L,水1 000 mL,pH自然。脂肪酶筛选培养基(甘油三丁酸酯培养基):甘油三丁酸酯乳化液10 mL/L,蛋白胨10 g/L,NaCl 0.5 g/L,MgSO4·H2O 0.5 g/L,琼脂18 g/L,pH 自然。初始发酵培养基:动物蛋白胨40 g/L,蔗糖20 g/L,橄榄油乳化液20 mL/L, MgSO4·7H2O 1 g/L,KH2PO4 1 g/L,pH自然。所有培养基在使用前必须在121 ℃下灭菌30 min。
1.2 试验方法
1.2.1 产脂肪酶菌株的筛选。将保藏在-20 ℃的供试菌株挑取少量菌丝,接种在PDA培养基平板上并置于25 ℃的恒温培养箱中培养10 d。将甘油三丁酸酯培养基配制好后,于121 ℃下灭菌。然后,将培养基倒入90 mm培养皿中,冷却后,用无菌打孔器从活化菌株的平板中取直径约为7 mm的菌块,用无菌的镊子挑取菌块倒扣于甘油三丁酸酯培养基上。共进行3次平行试验,培养10~15 d后,观察菌落周围有清晰的区域表明脂肪酶的产生。
1.2.2 菌株鉴定。将低温脂肪酶产生菌株C41-3在 PDA 培养基上进行培养,获取菌丝体采用CTAB法提取真菌基因组 DNA,使用通用引物 ITS1 /ITS4 进行 rDNA-ITS 区段扩增。 PCR反应体系为50 μL,包括10×Buffer 5.0 μL,dNTP 4.0 μL,Taq DNA酶 0.5 μL,ITS 1.0 μL,ITS4 1.0 μL,DNA样品2.0 μL,超纯水36.5 μL。扩增条件:94 ℃ 预变性 10 min;94 ℃ 变性 30 s,54 ℃退火 30 s,72 ℃延伸 30 s,35 个循环;72 ℃延伸 10 min。PCR 产物用 1.5% 琼脂糖凝胶电泳检测,扩增序列送至上海生工生物工程有限公司进行测序。将菌株C41-3的 rDNA-ITS 序列与GenBank 中相关序列进行相似度比较,并用MEGA 6.0软件基于邻接法( neighbor-joining)构建系统发育树。
1.2.3 脂肪酶生产。将配制好的种子培养基分装于若干个250 mL的锥形瓶中,每个锥形瓶装种子培养基100 mL,121 ℃灭菌30 min,然后冷却。将3个7 mm直径的菌块放入含有100 mL种子培养基的锥形瓶中,并放于摇床培养。温度为25 ℃,转速150 r/min,培养4 d后获得发酵种子液。
取配制好的30%的初始发酵培养基加至250 mL锥形瓶中,121 ℃灭菌30 min,冷却到室温;在10%的接种量下,将7.5 mL发酵种子液体加入含有产酶发酵培养基的锥形瓶中。发酵温度为25 ℃,pH自然,转速150 r/min,发酵培养4 d。取出发酵液,用高速冷冻离心机在4 ℃下以10 000 r/min离心发酵液10 min,收集上清液获得粗酶液。
1.2.4 脂肪酶活性测定。根据Alami等[21]的研究,用棕榈酸对硝基苯酯(p-nitrophenyl palmitate,p-NPP)作为底物,测定其低温脂肪酶活性。溶液A:0.015 g p-NPP溶于5 mL异丙醇中; 溶液B:在45 mL的0.05 mol/L Tris-HCl缓冲液(pH 8.0)中加入0.05 g阿拉伯树胶和0.2 mL Triton X-100。使用p-NPP为底物,将5 mL溶液A与45 mL溶液B均匀混合,将一种酶样品分成4个试管,每个试管加入1.8 mL的混合液,并在37 ℃预热5 min。其中3个试管加入200 μL酶样品溶液,另外1个试管加入200 μL经煮沸变性(100 ℃,10 min)的酶样品溶液作为对照,混合均匀。试管在37 ℃水浴反应15 min,取出后于波长410 nm的分光光度计下测定吸光度。脂肪酶活性单位定义为在测量条件下释放1.0 μmol/min对硝基苯酚( p-NP)所需的酶量[5]。