桑多酚微囊的制备及其特性研究
作者: 赵鹏 杨尚 张慧玲 温伦军 胡霞 孙海鹏 崔自学 侯启瑞
摘要 以β-环糊精为壁材,桑多酚提取液为芯材,采用冷冻干燥法制备桑多酚微囊,并对其特性进行研究。结果表明,桑多酚微囊包埋率随β-环糊精的增加而提高,二者比值≤1∶3时多酚含量和包埋率趋于稳定;扫描电镜观察,桑多酚微囊分散效果较好;微囊化可以显著改善桑多酚在贮藏期间的稳定性,减少多酚在胃液中的损耗,增加其在肠液中的释放量;桑多酚微囊对·OH、DPPH·和O-2 ·的清除率与桑多酚相当,说明微囊化未影响其抗氧化活性。
关键词 桑多酚;微囊;制备;冷冻干燥;特性;抗氧化
中图分类号 R285 文献标识码 A 文章编号 0517-6611(2024)06-0166-04
doi:10.3969/j.issn.0517-6611.2024.06.036
开放科学(资源服务)标识码(OSID):
Study of Preparation and Characterization of Mulberry Polyphenol Microcapsules
ZHAO Peng1, YANG Shang1, ZHANG Hui-ling2 et al
(1. Sericulture Research Institute of Henan Province, Zhengzhou, Henan 450007;2. Jiangsu University of Science and Technology, Zhenjiang, Jiangsu 212100)
Abstract The microcapsules of mulberry polyphenol were prepared by freeze-drying method with β-cyclodextrin as wall material and mulberry polyphenol extract as core material, and their characteristics were studied. The results showed that the embedding rate of mulberry polyphenol microcapsules increased with the increase of β-cyclodextrin, and the polyphenol content and embedding rate tended to be stable when the ratio ≤ 1∶3. Scanning electron microscopy showed that the dispersion effect of mulberry polyphenol microcapsules was good. Microencapsulation significantly improved the stability of mulberry polyphenol during storage, reduced the loss of that in gastric fluid and increased the release in intestinal fluid. The clearance rate of ·OH,DPPH· and O-2 · in mulberry polyphenol microcapsules was like that of mulberry polyphenol, indicating that the microencapsulation did not affect its antioxidant activity.
Key words Mulberry polyphenols;Microcapsules;Preparation;Freeze drying;Characteristics;Antioxidation
桑(Morus alba L.)是多年生叶用经济作物,具有耐贫瘠、耐干旱、适应性强等特点,在我国有较广的栽培范围。据估计,我国桑树的种植面积超过106 hm2,鲜桑叶的生物质产量每年25~30 t/hm2,是目前木本叶用植物中产量最高的树种之一[1]。几百年来,桑叶一直被用作蚕的饲料。基于其抗氧化、抗菌和降血脂的特性,桑叶也被用于中草药。近年来,人们对桑叶的营养价值和治疗功效有了新的认识,桑叶及其提取物正被广泛应用于饲料和动物养殖,在提高动物生产性能、饲料转化效率和畜产品品质等方面效果显著[2-3]。
多酚是植物中的酚类次生代谢产物,在植物叶、果、皮、根中广泛存在。桑多酚占桑叶干重的l%~3%,具有较强的清除羟自由基和氧自由基活性,是亟待开发的蕴藏在我国总量较大的一种植物天然抗氧化剂[4]。植物多酚苯环上有多个羟基,可发生消去、取代、置换和显色等化学反应,在自然界中具有高度不稳定性,储存过程还会受到氧化剂、热、光和酶反应的影响,降低多酚化合物的生物利用度[5]。微囊技术是以天然或人工合成的高分子材料为壁材,以所保护的物质为芯材,通过微囊化减少芯材与外界环境接触,使其免遭光照、温度或氧化物的破坏,提高稳定性[6]。研究显示,微囊技术可以显著改善多酚的稳定性和贮藏性,且微囊有缓释作用,可防止多酚被消化液破坏而吸收不完全[7]。微囊化常用的壁材有麦芽糊精、普鲁兰、凝乳素、海藻酸钠、果胶、β-环糊精等。Hamid 等[8]以麦芽糊精为壁材,通过冷冻干燥进行微囊化,克服了野生石榴黄酮不稳定的缺点,提高了其生物利用度。徐冉等[9]采用微囊技术将天然除虫菊酯包埋在β-环糊精的中空疏水区,结果表明微囊相对原材料具有较好的热稳定性和缓释性能。β-环糊精分子为立体结构,环中间有空洞,边缘具有亲水性或极性,能溶于水,不溶于乙醇和其他有机溶剂[10]。该研究以β-环糊精为壁材,桑多酚为芯材,通过冷冻干燥的方法制备桑多酚微囊,并对其缓释特性、稳定性和抗氧化性能进行检测,以期获得较好的桑多酚微囊产品,促进桑叶资源在食品、饲料添加剂等方面的开发利用。
1 材料与方法
1.1 试验材料
1.1.1 试材。
新鲜桑叶采摘于镇江中农蚕桑技术服务有限公司桑园,样品65 ℃烘至恒重,粉碎后过60目筛。
1.1.2 试剂。β-环糊精、没食子酸(纯度99%)、十二烷基硫酸钠(SDS)、福林-酚试剂、无水乙醇、钨酸钠、磷钼酸、磷酸、碳酸钠,均为分析纯,镇江华东器化玻有限公司。
1.1.3 仪器与设备。
Beta 2-8 LSC basic冻干机(Christ Sigma仪器设备北京有限公司);ST16 ST16R高速冷冻离心机(赛默飞世尔科技中国有限公司);UV-2401PC紫外可见分光光度计(岛津香港有限公司);MH-1500S 型超声波清洗器(湖南米函仪器科技有限公司);HH-4数显恒温水浴锅(国华电器有限公司);85-2型恒温磁力搅拌器(江苏省常州市国华仪器制造有限公司)。
1.2 试验方法
1.2.1 桑多酚提取物的制备。
桑叶粉25 g,按1∶25料液比加入0.34%十二烷基硫酸钠(SDS)、60%乙醇,61 ℃超声15 min,超声功率260 W。然后将提取液置于离心管中3 000 r/min离心15 min,上清液在旋转蒸发器中50 ℃浓缩至原体积的1/4。
1.2.2 桑多酚微囊的制备。
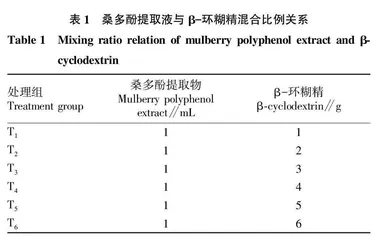
β-环糊精按照表1的比例加至浓缩液中,不断搅拌2 h使其完全均质,然后-80 ℃冷冻24 h。样品用冻干机在-30 ℃、0.04 hPa真空压力下冷冻干燥,研钵磨成粉,放入琥珀色瓶中备用。
1.2.3 没食子酸
标准曲线的绘制。精密称取没食子酸标准品0.011 0 g,用蒸馏水溶解并定容至100 mL,得浓度为0.11 mg/mL的标准液。准确吸取0、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL标准液置于25 mL容量瓶中,加蒸馏水6.0 mL,然后分别加入福林-酚试剂0.5 mL,混匀,再加入1.5 mL 20%碳酸钠溶液,充分混合后定容。30 ℃避光放置30 min,以不加标准液的6.0 mL蒸馏水为空白对照,760 nm下测定吸光度。以没食子酸在反应体系中的质量浓度为横坐标、吸光度为纵坐标绘制标准曲线(图1)。
1.2.4 桑多酚微囊包埋率的测定。
1.2.4.1 桑多酚微囊表面多酚含量的测定。
桑多酚微囊1.00 g先溶于一定量水中再定容至100 mL,3 000 r/min离心15 min,取上清液1 mL定容至25 mL,10 min后以没食子酸标准溶液为空白对照,760 nm下测定吸光度,根据标准曲线计算出微囊表面多酚含量。
1.2.4.2 桑多酚微囊总多酚含量的测定。
1.00 g桑多酚微囊溶于30 mL无水乙醇,充分搅拌以利于壁材的溶解。用蒸馏水定容至100 mL,61 ℃超声15 min,超声功率260 W,取上清液1 mL定容至25 mL,10 min后测吸光度,根据标准曲线计算出微囊总多酚含量。
1.2.4.3 桑多酚微囊包埋率。根据以下公式计算桑多酚微囊包埋率:
包埋率=(1-桑多酚微囊表面多酚含量/桑多酚微囊总多酚含量)×100%。
1.2.5 桑多酚微囊显微形态观察。
少量桑多酚微囊黏附于双面胶上,镀金后放入扫描电镜样品室,抽真空,观察微囊结构并拍照留存。
1.2.6 桑多酚微囊在人工胃、肠液中多酚释放的测定。
1.2.6.1 人工胃、肠液的配制。
人工胃液:800 mL水中加入16.4 mL稀盐酸和10 g胃蛋白酶,混匀,定容至1 000 mL。
人工肠液:称取6.8 g KH2PO4加入500 mL水中,搅拌均匀,然后用4% NaOH调节pH至6.8,再加入10 g胰酶混匀,定容至1 000 mL。
1.2.6.2 模拟胃肠环境的释放。
0.5 g T4组桑多酚微囊加入100 mL预热的(37.5~38.0 ℃)人工胃液或肠液中,300 r/min不断搅拌,在10、20、30、60、120、180、240、300 min取样,544 nm 处测定吸光度并计算多酚含量。通过计算累积释放度观察桑多酚微囊的缓释效果:
累积释放度=(最大释放时的多酚含量/总多酚含量)×100%。
1.2.7 桑多酚微囊稳定性测定。
将3 g桑多酚微囊和桑多酚室温下敞口放置20 d,每隔5 d取0.5 g样品测定多酚含量,计算多酚保留率:多酚保留率= 贮藏后样品中多酚含量/起始样品中多酚含量×100%。
1.2.8 桑多酚微囊抗氧化性测定。
1.2.8.1 清除羟基自由基(·OH)。
2 mL磷酸盐缓冲液(pH 7.4)、1 mL邻二氮菲(1.5 mmol/L)和1 mL FeSO4(1.5 mmol/L)混匀,分别加入1 mL相同质量分数的桑多酚微囊或桑多酚溶液,混匀,然后加入1 mL H2O2(0.02%),补充体积至8 mL,在536 nm处测吸光度,记为A样品;对照组以蒸馏水代替样液,空白组以蒸馏水代替 H2O2。·OH 清除率的计算公式:清除率=(A对照-A样品-A空白)/A对照×100%。
1.2.8.2 清除二苯基苦基苯肼自由基(DPPH·)。
取2 mL相同质量分数的桑多酚微囊或桑多酚溶液,加入2 mL DPPH溶液(称取8.05 mg DPPH溶解于无水乙醇,以无水乙醇定于100 mL,即为0.2 mmol/L DPPH溶液),混匀,30 min后在517 nm 处测吸光度,记为A样品;对照组以乙醇代替样液,空白组以无水乙醇代替DPPH溶液。DPPH·清除率的计算公式:清除率=(A对照-A样品-A空白)/A对照×100%。