凡纳滨对虾大棚循环水养殖中后期底泥菌群多样性及结构分析
作者: 油九菊 夏枫峰 王蕾飞 王易帆 范卫明
摘要 [目的]对凡纳滨对虾大棚循环水养殖中后期底泥菌群多样性及结构进行分析。[方法]在凡纳滨对虾大棚循环水养殖50、65、80、95、110 d时采集虾塘底泥样品,利用16S rRNA高通量测序技术分析其水体环境中微生物群落结构特征及多样性。[结果]养殖中后期,以变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为主要优势菌,二者相对丰度分别在50、65 d时达到最高(分别为84.96%、38.08%);属水平上,养殖中期以远洋杆菌属(Pelagibacter)、弓形杆菌属(Arcobacter)、红杆菌科未分类属为优势属,养殖后期(95、110 d)以α-变形菌纲的远洋杆菌属(Pelagibacter)为共同的优势类群,且110 d时其相对丰度高达41.02%;80 d时,无明显优势属。Shannon-Wiener多样性指数随养殖时间的延长呈先升后降的趋势,80 d时Shannon-Wiener多样性指数达到最高(7.24)。通过主成分分析和聚类分析发现,80和95 d时采集的样品菌群多样性相似性最高;其余时间点样品菌群多样性无明显差异。[结论]该研究结果表明循环水养殖系统可以优化凡纳滨对虾养殖水体微生物菌群环境,改善水体菌群结构及多样性,对于凡纳滨对虾实际养殖生产具有重要的指导作用。
关键词 凡纳滨对虾;循环水养殖;多样性;菌群结构
中图分类号 S931 文献标识码 A 文章编号 0517-6611(2024)15-0097-05
doi:10.3969/j.issn.0517-6611.2024.15.021
开放科学(资源服务)标识码(OSID):
Diversity and Structure Analysis of Microbial Flora in Bottom Mud During the Middle and Late Stages of Culture in the Greenhouse Recycling Water Aquaculture of Litopenaeus vannamei
YOU Jiu-ju, XIA Feng-feng, WANG Lei-fei et al
(Zhoushan Fisheries Research Institute of Zhejiang Province,Zhoushan,Zhejiang 316021)
Abstract [Objective] To analyze the diversity and structure of sediment microbial flora in the middle and later stages of greenhouse recirculating-water aquaculture of Litopenaeus vannamei. [Method] The sediment samples were collected from the pond of L. vannamei on the 50, 65,80,95 and 110 days in the greenhouse recirculating-water aquaculture of L. vannamei. The characteristics and diversity of microbial communities in water environment were analyzed by using 16S rRNA high-throughput sequencing technology. [Result] In the middle and late stages of breeding, Proteobacteria and Bacteroidetes were the main dominant bacteria, and the relative abundance reached the highest values (84.96% and 38.08%) at 50 and 65 d respectively. At the level of the genus, Pelagibacter, Arcobacter, Rhodobacteraceae-unclassified were the dominant genera, Pelagibacter of Alphaproteobacteria was the common dominant group in the late stage of breeding (95 and 110 d), and its relative abundance reached 41.02% at 110 d. There was no obvious dominant genus at 80 d. Shannon-Wiener diversity index showed a trend of first increase and then decrease, it reached the highest level at 80 d (7.24). Principal component analysis and cluster analysis showed that the bacterial diversity of the samples collected at these two points had the highest similarity, and the bacterial diversity of the samples collected at other time points had no obvious difference. [Conclusion]The research results showed that the circular water aquaculture system could optimize the microbial community environment in the aquaculture water of L. vannamei, improve the structure and diversity of the water microbial flora, which had an important guiding role for the actual aquaculture production of L. vannamei.
Key words Litopenaeus vannamei;Circular water aquaculture;Diversity;Microbial flora structure
凡纳滨对虾(Litopenaeus vannamei),俗称南美白对虾,具有广温性、广盐性、生长速度快等优点,可以进行高密度集约化养殖生产,养殖经济效益显著,是目前对虾养殖品种中产量最高的三大优良品种之一。凡纳滨对虾经历3~4个月的生长周期后可以上市。随着对虾产业的高速发展,产业现代化、工厂化和集约化程度大幅度提高,各种对虾疾病频繁暴发,病害已成为对虾养殖业持续健康发展的主要瓶颈。凡纳滨对虾大棚循环水养殖模式是解决当前对虾养殖产业现有一系列问题的有效途径之一,也是对虾养殖模式发展的新方向。对虾养殖中后期,重在改良底质[1],而底泥是水层营养物质的重要来源[2]。底泥微生物对于促进底泥有机质分解、减少有机物的堆积以及保持良好的水质等方面发挥着重要作用[3],在刺参[4]、克氏原螯虾[5]、中华绒螯蟹[6]等品种养殖中已有学者进行了相关研究报道。了解养殖塘底泥细菌群落结构,掌握菌群多样性变化规律,可为改善养殖水体、对虾病害防治及规模化养殖中微生物资源的开发等提供基础数据。已有学者对凡纳滨对虾养殖水体菌群等开展了相关研究[7-10],但关于大棚循环水养殖模式下虾塘底质微生物菌群相关研究尚未见报道。笔者采用16S rRNA高通量测序方法对大棚内循环凡纳滨对虾养殖塘底质菌群情况进行分析,以期为更高效的养殖水环境调控和健康养殖模式提供技术支撑。
1 材料与方法
1.1 样品采集及预处理
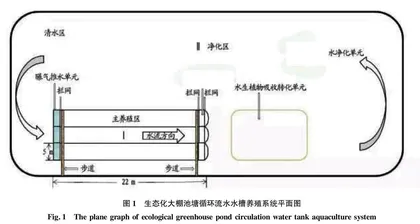
凡纳滨对虾养殖塘位于舟山市朱家尖科研基地,在原对虾高位池大棚养殖塘的基础上进行改造,在面积1 000 m2大棚池塘内新建流水水槽2个,长20 m、宽5 m、高2 m,建设面积200 m2,水槽采用钢筋混凝土结构,采用长方形倾斜底,于大棚外排水口处加装蛋白分离器(加臭氧)进行塘内循环水质的消毒处理,水处理主要流程为养殖区→净化区→清水区→蛋白分离器(加臭氧)→养殖区,如图1所示。
投放凡纳滨对虾苗种后50 d开始采样。于养殖塘对虾主养殖区中间位置,用采泥器采集虾塘约5 cm厚度底泥置于无菌采样袋中,立即置于4 ℃条件下带至实验室进行菌群DNA抽提。试验共设置50、65、80、95、110 d 5个采样时间点,分别记作A1~A5。
1.2 总基因组DNA提取
按照Mobio PowerSoil DNA Isolation Kit DNA分离试剂盒说明书,提取虾塘底泥细菌群落总基因组DNA,测定DNA浓度和纯度,最后利用1.5%的琼脂糖凝胶电泳检验核酸抽提质量。
1.3 PCR扩增及高通量测序
以提取的总DNA为模板,用引物343F(5′-TACGGRAGGCAGCAG-3′)和798R(5′-AGGGTATCTAATCCT-3′)扩增微生物16S rRNA V3~V4区片段。扩增体系包括10×PCR Buffer(Mg2+ Free)5.00 μL,MgCl2+(25 mmol/L)4.00 μL,dNTP(10 mmol/L)4.00 μL,F/R primer(10 mmol/L)各2.00 μL,DNA(50 ng/μL)2.00 μL,Ex Taq 0.25 μL,用ddH2O补足50.00 μL。扩增程序如下:95 ℃变性5 min;然后,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,30个循环;最后,72 ℃延伸10 min,于4 ℃下保存。利用1.2%的琼脂糖凝胶电泳检测PCR产物后,进行PCR产物的纯化及回收。将纯化后的PCR产物送交测序公司进行Illumina Miseq高通量测序。
1.4 数据统计与分析
对测序数据进行OTU聚类分析,OTU(可操作分类单元,operational taxonomic unit)是人为给某一分类单元设置的同一标志。根据OTU聚类分析结果,评估底泥微生物菌落α多样性;基于分类学信息,在门、纲、属分类水平上对底泥群落结构进行分析。试验数据均以平均值±标准差表示,使用SPSS 17.0统计软件进行统计分析。
2 结果与分析
2.1 菌群多样性分析
从5组底泥样品中获得的有效序列数分别为25 505、30 986、33 813、27 497、30 888条,去除嵌合体后得到的有效序列碱基长度为251~450 bp;OTU聚类分析发现,5组样品获得的总OTUs数目为988个,各样品Tags和OTUs数目统计见表1。从不同养殖阶段样品的共有和独有OTU数目(图2)可以看出,大棚循环水系统能更好地优化环境中的菌群结构。
在该试验测序深度下,样品的稀释曲线趋于平缓,即随着测序条数的增加,获得的OTU数量变化不大(图3),说明该试验测序深度够大,足以覆盖样品的大多数微生物,测序数据量合理。通过香农-威纳多样性指数(Shannon-Wiener diversity index)对养殖塘底泥微生物群落多样性进行评估,发现养殖80 d时(A3)微生物Shannon-Wiener多样性指数最高(7.24),110 d时(A5)底泥中微生物Shannon-Wiener多样性指数降至4.87,接近50 d时(A1)的Shannon-Wiener多样性指数(4.75)(图4)。
2.2 菌群结构特征分析
该研究采集的5个底泥样品检测到的细菌群落隶属于26门59纲119目235科391属。通过对细菌群落门水平上相对丰度的分析可知,养殖中后期养殖底泥中细菌群落以变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为优势类群,且这2个门在采样期间一直是