海水中降解几丁质细菌的筛选鉴定及培养条件优化
作者: 祁红兵 张敏怡
摘要 [目的]从海水中获得高产几丁质酶菌株并优化培养条件。[方法]采集湛江市金沙湾海水作为样品,以胶体几丁质为唯一碳源筛选分离产几丁质酶菌株,DNS法测定酶活力并进行分子鉴定;单因素试验和正交优化其产酶最佳条件。[结果]初筛得到6株能降解几丁质的细菌,其中编号为Z-4的菌株几丁质酶活力最强,形态鉴别及16S rDNA序列分析鉴定为嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)。菌株Z-4优化后的最佳产酶条件为可溶性淀粉添加量1.5%、蛋白胨添加量2.5%、KH2PO4添加量0.04%,在30 ℃、pH 7.0、接种量2%、160 r/min、培养72 h,酶活力达到0.452 U/mL,相比优化前提高了5倍。[结论]研究结果为海洋副产物有效利用几丁质改善环境提供重要参考。
关键词 海水;细菌;几丁质酶;培养条件优化;筛选鉴定
中图分类号 S 917.1 文献标识码 A
文章编号 0517-6611(2024)16-0001-05
doi:10.3969/j.issn.0517-6611.2024.16.001
开放科学(资源服务)标识码(OSID):
Screening and Identification of Chitin Degrading Bacteria in Seawater and Optimizing Culture Conditions
QI Hong-bing,ZHANG Min-yi
(School of Life Science and Technology,Lingnan Normal University,Zhanjiang,Guangdong 524048)
Abstract [Objective] To obtain high-yield chitinase strains from seawater and optimize culture conditions.[Method]The seawater from Jinsha Bay of Zhanjiang City was collected as samples,chitinase producing strains were isolated using colloidal chitin as the only carbon source,the enzyme activity was measured by DNS method and molecular identification;single factor experiment and orthogonal optimization were used to optimize the optimal conditions for enzyme production.[Result]Six strains of chitinase-degrading bacteria were screened.The strain with the strongest chitinase activity was Z-4.The strain was identified as Stenotrophomonas maltophilia by morphological observation and 16S rDNA sequence analysis.The optimum conditions for producing enzyme of strain Z-4 were obtained as follows:soluble starch addition of 1.5%,peptone addition of 2.5%,KH2PO4 addition of 0.04%;at 30 ℃,pH 7.0,inoculation amount of 2%,160 r/min and 72 hours of cultivation,the enzyme activity reached 0.452 U/mL,which was 5 times higher than before optimization.[Conclusion]The research results provide an important reference for the effective use of chitin in the ocean to improve the environment.
Key words Seawater;Bacteria;Chitinase;Optimization of culture conditions;Screening and identification
基金项目
湛江市非资助科技攻关计划项目(2023B01023);岭南师范学院校级教育教学改革项目 (岭师教务〔2022〕154号)。
作者简介 祁红兵(1971— ),男,河南信阳人,副教授,博士,从事微生物生理研究。
收稿日期 2023-09-13
几丁质是世界上含量巨大的生物多聚体之一,其广泛存在许多物种的体内和外壳中,如线虫的表皮、真菌的细胞壁、节肢动物的外骨架以及许多昆虫的肠道[1]。几丁质是一种多糖,在生物体内并不是以游离的状态存在的,而是与其他物质结合在一起,因此几丁质的开发利用需要对含几丁质的原料进行处理,分离出几丁质[1]。目前主要通过化学法对几丁质原料进行降解,从而产生壳聚糖、几丁质寡糖及其衍生物,但这种方法容易造成环境污染,与国家倡导的绿色发展理念相悖[2-3]。几丁质的降解产物具有调节血糖、抗肿瘤、降血脂、抗菌等作用,目前已被应用于医药、化工、食品、环保等领域[4]。几丁质酶是指能够催化水解几丁质的酶类总称,在自然界几乎所有生物类群中都能发现几丁质酶的存在[5]。微生物几丁质酶在农业、工业、食品、医药等领域展现出良好前景[6]。
地球表面积的3/4约为海洋,由于海洋生物资源数不胜数,各海洋大国纷纷把目光投向了海洋生物资源的研究开发上,其中海洋生物酶的研究便是各国的重点研究对象之一[7-9]。但自然界中产几丁质酶的微生物普遍存在产酶量低、生产成本过高、酶活力低等问题,使得在实际中的应用并不多。因此,加大对海洋生物资源的研究,从海洋微生物中分离高产几丁质酶的菌株具有重大的意义。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株。
湛江金沙湾有不少贝类、虾、蟹等,每年都会产生较多的壳类废弃物,为几丁质酶产生菌提供了适宜的生长和繁殖条件,因此以湛江金沙湾采集的海水作为样品,从中分离筛选能产几丁质酶的细菌。
1.1.2 培养基。
平板分离培养基:蛋白胨0.500%,七水硫酸镁0.001%,七水硫酸锌0.001%,胶体几丁质0.500%,磷酸二氢钾0.005%,琼脂2.000%,pH 7.0。种子培养基:蛋白胨0.500%,七水硫酸镁0.001%,七水硫酸锌0.001%,胶体几丁质0.500%,磷酸二氢钾0.005%,pH 7.0。发酵培养基:蛋白胨0.500%,七水硫酸镁0.001%,七水硫酸锌0.001%,胶体几丁质0.500%,磷酸二氢钾0.005%,pH 7.0。
1.1.3 主要试剂。
N-乙酰-D-氨基葡萄糖(NAG),分析纯,润友化学(深圳)有限公司;甲壳素,分析纯,上海麦克林生化科技有限公司;3,5-二硝基水杨酸(DNS),武汉卡诺斯科技有限公司;细菌基因组DNA提取试剂盒,北京索莱宝科技有限公司;PCR引物,英潍捷基(上海)贸易有限公司。
1.1.4 主要仪器。
生化培养箱(SPL-150,广州瑞彬科技有限公司) ;紫外可见分光光度计(752N,上海仪电分析仪器有限公司);凝胶成像仪(ChampChemi Professional,北京三江锐志科技有限公司);电泳仪(DYY-6C,成都一科仪器设备有限公司);紫外投射反射仪(WFH-201B,上海精科实业有限公司);基因扩增仪器(A300,杭州朗基科学仪器有限公司)。
1.2 试验方法
1.2.1 胶体几丁质的制备。
精确称量细粉几丁质5 g,加入100 mL浓盐酸混匀,放置24 h,边搅拌边过滤到500 mL的蒸馏水中,静置至沉淀析出,离心后收集胶体几丁质,蒸馏水冲洗至中性,用0.2 mmol/L磷酸缓冲液定容,使胶体几丁质溶液的最终浓度为1%[10-11]。
1.2.2 DNS溶液的制备。
参照付星等[12]的方法,称取3,5-二硝基水杨酸6.3 g,加入500 mL蒸馏水,搅拌并加热使其溶解,逐步加入300 mL 10% NaOH溶液,同时不断搅拌,按顺序依次加入182 g酒石酸钾钠、5 g结晶酚和5 g Na2SO3,搅拌并加热使其溶解(温度不宜超过50 ℃),待溶液冷却至室温后,定容至1 L,棕色瓶中储存备用,室温下放置7 d后使用。
1.2.3 N-乙酰-D-氨基葡萄糖(NAG)标准曲线的绘制。
1.2.3.1 NAG标准溶液的配制。用适量蒸馏水将100 mg的NAG溶解,定容至100 mL,配制成浓度为0.1%的NAG标准溶液,并置于4 ℃冰箱保存。
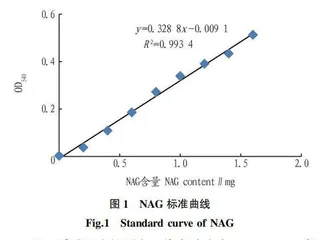
1.2.3.2 标准曲线的绘制。依次将NAG标准溶液、蒸馏水和DNS溶液加入试管中,混匀后,煮沸5 min。迅速冷却后,定容至25 mL,以不加NAG标准液的0号管为对照调零,用紫外可见分光光度计在540 nm处测定吸光度。以吸光度为纵坐标、NAG含量为横坐标绘制标准曲线(图1),得出线性回归方程y=0.328 8x-0.009 1(R2=0.993 4)。
1.2.4 几丁质酶活力的测定。将发酵液在6 000 r/min离心15 min,取上清液0.5 mL加入1 mL的1%胶体几丁质,于40 ℃中反应30 min,以灭活的上清液作为对照,加入1.5 mL蒸馏水和1.5 mL DNS,充分混匀,在沸水浴中加热5 min,迅速用流水冷却至室温,定容至25 mL,在540 nm测吸光度[13-14],并根据NAG标准曲线线性回归方程计算出NAG含量。酶活力计算公式如下:
酶活力(U/mL)=m×n×1 000/(M×T×V)
式中:m为NAG含量;n为稀释倍数;M为NAG相对分子量(221.21);T为反应时间;V为酶液体积。
1.2.5 产几丁质酶菌株的分离纯化。
1.2.5.1 初筛。
取1 mL样品加入装有9 mL无菌海水的试管中,混匀,分别稀释制成不同倍数的稀释液。从10-4~10-7 的4管海水稀释液中各吸取0.1 mL,均匀地涂布在平板分离培养基上,在30 ℃条件下培养96 h[15]。
1.2.5.2 复筛。
从初筛平板中挑取能够产生透明圈的菌株,进行划线分离纯化。取划线后长出的单菌落接入到种子培养基中,30 ℃、摇床160 r/min振荡培养24 h,取种子液0.6 mL 接入30 mL发酵培养基中,同样条件下振荡培养5 d,取发酵液在6 000 r/min的条件下离心15 min,收集上清粗酶液,测定酶活力,斜面培养基中保存酶活力较高的菌株。
1.2.6 菌株的形态观察。