外泌体蛋白质组学在植物与微生物互作中的研究进展
作者: 潘丽英 白琳琳 周庆峰 裴冬丽 王文静 高航
摘要 外泌体内含蛋白质、核酸、脂类以及小分子化合物等多种生物信息分子,在植物与微生物互作过程中具有重要功能,是当前植物与微生物互作研究的前沿热点。作为多种生物信息分子的载体,外泌体的组成成分决定其功能。因此,通过蛋白质组学技术分析外泌体的蛋白组成有助于深入解析其在植物与微生物互作过程中的功能。系统总结了外泌体蛋白质组学在植物与真菌、细菌互作过程中的研究进展,重点阐述外泌体蛋白组成与植物抗病信号传导及病原菌毒力的相关性,并在此基础上提出外泌体蛋白质组学的发展方向,为深入解析植物与微生物的互作机制提供借鉴。
关键词 外泌体;细胞外囊泡;植物免疫;蛋白质组学;病原菌
中图分类号 S 432.2+3 文献标识码 A
文章编号 0517-6611(2024)16-0013-07
doi:10.3969/j.issn.0517-6611.2024.16.003
开放科学(资源服务)标识码(OSID):
Research Progress of Exosomal Proteomics in Plant-microbe Interactions
PAN Li-ying,BAI Lin-lin,ZHOU Qing-feng et al
(College of Biology and Food,Shangqiu Normal University/Henan Provincial Key University Laboratory of Plant-Microbe Interactions,Shangqiu,Henan 476000)
Abstract Exosomes,a cutting-edge focal point in current research on plant-microbe interactions,are vesicles that encompass diverse biomolecular information including proteins,nucleic acids,lipids,and small molecules.They assume significant roles in the progression of plant-microbe interactions.The composition of exosomes plays a crucial role in determining their function as carriers of various biological information molecules.Therefore,the functional roles of exosomes in the interactions between plants and microorganisms can be revealed by analyzing their protein composition using proteomic techniques.This paper provides a comprehensive overview of the current research advancements in exosome proteomics within the context of plant-fungi and plant-bacteria interactions.The primary focus is on analyzing the protein composition of exosome and exploring their significance in plant disease resistance signaling and pathogen virulence.Additionally,this article suggests potential future directions for the development of exosomal proteomics,with the aim of shedding light on the underlying mechanisms involved in plant-microorganism interactions.
Key words Exosome;Extracellular vesicle;Plant immunity;Proteomics;Pathogen
基金项目 河南省高等学校重点科研项目(23B210004)。
作者简介 潘丽英(1987—),女,河南商丘人,助理实验师,硕士,从事植物与微生物互作机理研究。*通信作者,讲师,博士,硕士生导师,从事植物与微生物互作机理研究。
收稿日期 2023-12-27
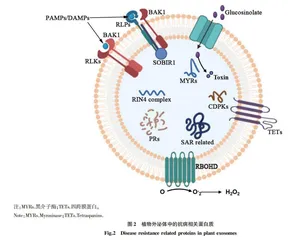
细胞外囊泡(extracellular vesicles)是细胞向外部环境分泌的脂双层膜泡,在调控生长发育、免疫反应、癌症的发生发展以及病毒的转移等过程中具有重要作用[1]。细胞分泌3种不同类型的膜泡,包括凋亡小体、细胞微泡和外泌体(exosome)。外泌体是直径30~150 nm的脂双层膜泡,其内含核酸、蛋白质、脂类及小分子化合物等多种生物信息分子,在细胞间通信过程中具有重要功能[2-3]。动物细胞分泌的外泌体能够经体液系统被临近或远端靶细胞摄取,向靶细胞传递生物信息分子,进而调控靶细胞的功能[4]。最新的研究显示,植物及植物源微生物也能够分泌外泌体,这些外泌体介导生物信息分子在植物与微生物间的跨界传递,从而参与植物与微生物的互作过程[5-9]。微生物分泌的外泌体中包含多种microRNA、毒力蛋白和病原菌相关的分子基序(pathogen-associated molecular patterns,PAMPs),从而抑制或诱导植物的抗性[5,10-12]。而植物分泌的外泌体能够向微生物中转运抗病蛋白及靶标微生物毒力基因的microRNA,进而抑制微生物的生长[6,8-9]。蛋白质是细胞功能的直接执行者,在细胞生命活动过程中具有至关重要的作用。因此,通过蛋白质组学分析外泌体的蛋白组成有助于深入解析植物与微生物互作的分子机理。该研究系统总结了外泌体蛋白质组学在植物与真菌、细菌互作过程中的研究进展,包括植物外泌体的抗菌机制及介导抗病信号的传导机制、真菌外泌体在真菌侵染植物过程中的功能,以及细菌外泌体激发植物先天性免疫机制等,以期为深入揭示外泌体在植物与微生物互作过程中的功能提供参考。
1 外泌体分离技术
1.1 植物外泌体的分离方法
目前,提取植物外泌体使用最多的方法是超速离心法,其首要步骤是获得高质量的植物质外体液[6-9,13]。具体分离方法为:①将植物叶片浸入至渗透液中,抽真空至叶片呈浸润状,700 g离心分离植物质外体液;②0.45 μm滤膜过滤去除细胞杂质和大囊泡;③5 000、10 000 g差速离心进一步去除细胞碎片和杂质;④100 000 g超速离心沉淀外泌体(图1)。所获得的外泌体经重悬后可进一步使用密度梯度离心纯化。此外,He等[14]使用免疫亲和捕获的方法纯化出拟南芥富含四跨膜蛋白TET8的外泌体。此方法能够获得具有特定特征的外泌体亚类。在动物系统,提取外泌体方法还有微流体分离、体积排阻色谱等[15]。但目前尚未见使用此类方法分离植物外泌体的相关报道。
1.2 微生物外泌体的分离方法
与植物类似,超速离心法是分离细菌及真菌外泌体最常用的方法(图1)。其具体分离方法为:①获得细菌、真菌的培养液;②差速离心去除培养液中的杂质及细胞碎片;③0.45 μm滤膜过滤进一步去除杂质及大的胞外囊泡;④100 000~150 000 g超速离心沉淀外泌体。目前已使用超速离心法成功从多种细菌、真菌及卵菌中成功分离出外泌体(图1)。此外,研究人员使用体积排阻色谱法从镰刀菌培养液中提取出外泌体[16]。而Rutter等[17]通过透射电镜发现炭疽病菌分泌的外泌体被限制在细胞壁与细胞膜之间,仅能从炭疽病菌原生质体的培养上清中分离到外泌体,说明少数真菌的细胞壁会阻碍外泌体的分泌。
2 基于质谱的蛋白质组学研究方法
传统的蛋白质组学研究是采用双向电泳根据蛋白质的等电点和分子量分离蛋白质,经过图像对比分析后采用质谱鉴定差异点中的蛋白。由于双向电泳技术具有通量低、分辨率低、重复性差等缺点[18],目前已逐渐被基于高效液相色谱串联质谱(LC-MS/MS)蛋白质组学技术所替代。随着质谱精度和扫描速度的提升,可对样本中上万个蛋白质进行定性和定量分析[19]。基于LC-MS/MS蛋白质组学技术的核心流程为:①抽提样本蛋白质;②采用蛋白酶将蛋白质酶解为肽段;③使用高效液相色谱分离肽段,肽段经离子化后进入质谱;④通过一级和二级质谱对肽段进行定性和定量;⑤检索数据库并进行生物信息学分析。根据检测目的不同,蛋白质组学可分为定性蛋白质组学和相对定量蛋白质组学。定性蛋白质组学主要用于检测样品中的蛋白成分或含有某种翻译后修饰蛋白质的种类,而定量蛋白质组学主要用于检测蛋白质含量或修饰蛋白质的含量在不同样本中的变化。与常规蛋白质组学不同,由于在总蛋白中含有某一特定修饰的蛋白质所占比例较低,因此修饰蛋白质组学需要从总肽段中富集目标修饰肽段。其基本原理为使用能够特异吸附修饰肽段的材料富集修饰肽段。如采用含有阳离子亲和吸附磷酸基团的 IMAC(Fe3+)技术富集磷酸化肽段,采用特异性抗体富集泛素化肽段、乙酰化肽段、甲基化肽段,采用凝集素富集糖基化肽段等[20]。目前,常用的基于LC-MS/MS的定量蛋白质组学方法有非标记定量蛋白质组学和标记定量蛋白质组学。
非标记定量蛋白质组学是指每个样品的肽段单独上机,经高效液相色谱分离、离子化后进入质谱,通过肽段一级质谱(MS1)的峰面积定量肽段,通过肽段的二级碎裂(MS2)模式定性肽段。通常采用数据依赖模式(DDA)采集肽段的MS2信息。在DDA模式下,质谱仅能采集丰度较高肽段的MS2信息,而漏掉大量低丰度肽段的MS2信息。因此,基于DDA模式的非标记定量蛋白质组学稳定性较差,数据量较小[21]。目前几乎所有的植物及植物源病原菌外泌体蛋白成分的鉴定均采用此方法(表1)。近年来随着质谱性能的提升,在数据非依赖模式(DIA)下采集肽段的MS2信息成为现实。在DIA模式下,质谱能采集所有的MS2信息,极大提升了数据的重现性及数据量[31]。
标记定量蛋白质组学是指采用含有不同报告基团的同位素标记不同样品的肽段,通过质谱对样品中的肽段进行定性和定量分析。常用的商业化同位素标记试剂有ITRAQ、TMT和SILAC[32]。其中ITRAQ和TMT试剂用于体外标记,即直接标记酶解后的肽段。而SILAC试剂主要用于体内标记,即在细胞培养过程中将含有同位素标记的氨基酸加入培养基,通过细胞代谢将同位素标记的氨基酸引入新合成的蛋白质中。ITRAQ和TMT试剂最多可同时标记8和16个样品,而SILAC试剂最多可同时标记3个样品。与非标记定量蛋白质组学相比,同位素标记蛋白质组学有如下优势:①重现性好。不同样品肽段被同位素标记后,质谱可根据同位素的不同区分相同肽段属于哪组样品,因此可将同位素标记的不同样本的肽段混合后通过一次上机试验对所有样本中的肽段进行定性和定量分析,避免由于质谱的稳定性所引入的误差;②数据量大。将同位素标记的不同样本肽段混合后可进行二维高效液相色谱分离,即首先根据肽段特性(如离子特性、pH等)将肽段分为不同组分,然后将不同组分分别进行LC-MS/MS分析。此方法能有效降低高丰度肽段对低丰度肽段检测的干扰[33]。然而,由于同位素标记技术需要较大的样本量,目前尚未见采用此方法对植物及植物源病原菌外泌体进行蛋白质组学分析的相关报道。