黄鳝雄激素受体生物信息学分析
作者: 凌智 杨文林 袁汉文
摘要 为了进一步研究黄鳝(Monopterus albus)雄激素受体的结构与功能,利用生物信息学方法对黄鳝雄激素受体的理化性质与空间结构进行了预测。结果表明,黄鳝雄激素受体基因全长2 774 bp,完整开放阅读框2 238 bp,可以编码746个氨基酸。M.albus AR蛋白的分子量为83.71 ku,为酸性亲水的不稳定蛋白质,不具有信号肽和跨膜区域,不属于分泌蛋白。该蛋白有72个可能的磷酸化位点。该蛋白二级结构以α-螺旋和无规则卷曲为主。
关键词 黄鳝;雄激素受体;生物信息学分析
中图分类号 S 966.4 文献标识码 A 文章编号 0517-6611(2024)24-0080-06
doi:10.3969/j.issn.0517-6611.2024.24.019
开放科学(资源服务)标识码(OSID):
Bioinformatics Analysis of Androgen Receptor in Monopterus albus
LING Zhi1, YANG Wen-lin1, YUAN Han-wen1,2
(1.Yangtze University,Jingzhou, Hubei 434025;2.Hubei Province Monopterus albus Technology Research Center, Jingzhou ,Hubei 434025)
Abstract In order to further study the structure and function of the androgen receptor in the eel (Monopterus albus), bioinformatics methods were used to predict the physicochemical properties and spatial structure of M.albus AR. The results showed that M.albus AR gene had a total length of 2 774 bp, a complete open reading frame of 2 238 bp, and it could encode 746 amino acids. The molecular weight of M.albus AR protein was 83.71 ku, it was an acidic and hydrophilic unstable protein. It had no signal peptides or transmembrane regions and it was not a secreted protein. This protein had 72 possible phosphorylation sites.The second structure of this protein was mainly α-helix and random coil.
Key words Monopterus albus;Androgen receptors;Bioinformatics analysis
雄激素受体(androgen receptor,AR)是配体激活的转录因子[1],它的几个关键功能(如激素识别和辅调节因子等),都集中在配体结合域(LBD)中[2]。AR是类固醇受体的一种,通过招募辅激活子启动其靶基因的转录来激活基因转录。与其他类固醇受体相比,AR的激活功能在很大程度上依赖位于其N端结构域(NTD)的配体,AR二聚反应遵循独特的头对头和尾对尾方式,AR NTD是辅激活因子招募的主要场所[3]。雄激素受体基因突变是人类(Homo sapiens)性发育障碍(DSD)的主要原因之一,表现为性模糊或性逆转[4]。鳜鱼(Siniperca chuatsi)甲基睾酮(MT)诱导的雌雄性逆转过程中,MT处理30和35 d后ARβ的表达显著上调,提示ARβ可能在精子发生和雄性化过程中起关键作用。鳜鱼中分离到AR cDNA全长,在雌、雄鱼性腺和肝脏中均有高表达;在性别分化早期,雌鱼AR的表达在孵化后5~30 d均高于雄鱼,30 d 时达到高峰[5]。金钱鱼(Scatophagus argus)雄激素通过刺激AR表达、抑制雌性发育调控关键基因表达,从而影响卵巢发育[6]。在MT诱导石斑鱼(Epinephelus coioides)的性反转过程中,下丘脑和性腺中AR的表达模式表明AR参与调节这一过程[7]。
黄鳝(Monopterus albus)是一个具有性别反转特征的原始脊椎动物,黄鳝AR蛋白的羧基端配体结合结构域中的第553~588位氨基酸序列对睾丸素的结合很重要,它们的存在对羧基端配体结合结构域是否能形成正确的空间构象非常关键。黄鳝AR基因的表达水平在雄性性腺、脾脏和肝脏中较高,而在脑和雌性性腺中的表达量低于其他部位,而且随着黄鳝性腺逐步由雌性性腺向雄性性腺转变,黄鳝AR基因的表达量逐渐上升[8]。黄鳝AR不同于人类的AR,尤其是在配体结合域(LBD)中,其在性腺中的表达量由卵巢经卵睾向精巢的转化过程中呈增加趋势,且在DNA结合域和铰链区发现了一个功能核定位信号[9]。
AR在生物体中起到至关重要的作用,目前AR在其他生物体中的研究较多,在黄鳝中也有部分研究。笔者以黄鳝AR基因为研究对象,利用生物信息学的方法对其理化性质、跨膜区、疏水性、信号肽、蛋白质二级结构等进行预测分析,并与人类、鳜鱼、金钱鱼、石斑鱼的AR结构进行对比,旨在为进一步研究M.albus AR基因的功能提供一定参考。
1 材料与方法
1.1 试验材料
在NCBI网站(https:∥www.ncbi.nlm.nih.gov/)数据库中查询,得到黄鳝AR的氨基酸序列(XP_020454405.1)、人类AR氨基酸序列(NP_000035.2)、鳜鱼AR氨基酸序列(XP_044060142.1)、金钱鱼AR氨基酸序列(XP_046266164.1)、石斑鱼AR氨基酸序列(ADQ43815.1)。
1.2 试验方法
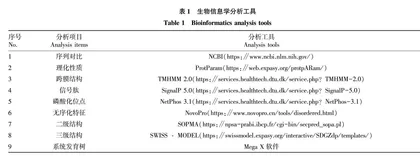
生物信息学分析工具如表1所示。利用表1 中分析工具对黄鳝、人类、鳜鱼、金钱鱼、石斑鱼进行AR氨基酸序列比对,对其理化性质、跨膜结构、信号肽、磷酸化位点、无序化特征、二级结构等进行预测。
2 结果与分析
2.1 AR蛋白的理化性质分析
利用ProtParam在线软件对5种生物的AR进行理化性质分析(表2),结果表明黄鳝
AR基因全长2 774 bp,开放阅读框长2 238 bp,编码合成746个氨基酸;蛋白分子量(MW)为83.71 ku,推断它为带有负电的、不稳定的亲水蛋白质,黄鳝AR蛋白总原子数为11 600个,分子式为C3672H5740N1022O1113S53。人类AR基因的开放阅读框长2 760 bp,编码合成920个氨基酸,蛋白分子量(MW)为99.19 ku,为带有负电的、不稳定的亲水蛋白质,蛋白总原子数为13 730个,分子式为C4342H6772N1220O1347S49。鳜鱼AR基因的开放阅读框长1 950 bp,编码合成650个氨基酸,蛋白分子量(MW)为72.29 ku,为带有正电的、不稳定的亲水蛋白质,蛋白总原子数为10 022个,分子式为C3131H4973N907O962S49。金钱鱼AR基因的开放阅读框长2 437 bp,编码合成768个氨基酸,蛋白分子量(MW)为86.66 ku,为带有负电的、不稳定的亲水蛋白质,蛋白总原子数为11 992个,分子式为C3811H5914N1064O1155S48。石斑鱼AR基因的开放阅读框长2 350 bp,编码合成759个氨基酸,蛋白分子量(MW)为84.70 ku,为带有负电的、不稳定的亲水蛋白质,蛋白总原子数为11 674个,分子式为C3704H5751N1021O1139S59。
在这5种生物中AR蛋白理论等电点(PI)均低于7,均属于酸性蛋白质。5种生物中,含量较高的氨基酸均为Leu,占8.3%~10.0%;含量较低的氨基酸均为Trp,占0.9%~1.1%,均不含Pyl和Sec,而Leu、Ser和Ala是这几种生物AR所共有的主要氨基酸。不稳定系数均高于40的阈值,说明此蛋白在这5种物种中均为不稳定蛋白。总平均疏水性均为负值,这5种生物AR蛋白质均为亲水性蛋白质。
2.2 AR蛋白的跨膜区、信号肽分析
利用TMHMM 2.0在线软件预测这5种生物的AR蛋白跨膜结构,结果显示该5种生物均不存在跨膜结构(图1)。
利用SignalP 5.0在线软件预测这5种生物AR蛋白的信号肽,结果表明均不存在信号肽(图2),推测该蛋白不属于分泌蛋白,或者带有信号肽的前体蛋白到运输部位跨膜后信号肽已被切除,并未折叠为成熟的蛋白质。
2.3 AR蛋白的亲水性、疏水性分析
用DNAMan 6.0软件预测这5种生物AR蛋白的氨基酸疏水性位点及分值(图3)。K-D标度用于评估氨基酸的疏水性,若大于0表示疏水性,若小于0表示亲水性。这5种生物AR各氨基酸分值多为负值,因此这5种生物AR蛋白均为亲水性蛋白。
氨基酸的亲水性、疏水性对蛋白质的结构和生理功能具有重要的作用。亲水性和疏水性氨基酸可以预测跨膜蛋白的位置,构成疏水的二级结构,便于蛋白质跨膜、形成更高级的结构,同时疏水氨基酸的疏水基团还可促进蛋白质二级结构的折叠[10]。
2.4 AR蛋白的无序化特征分析
蛋白质固有无序化特征是反映蛋白质功能的一个重要指标。该研究利用NovoPro程序对AR蛋白进行了折叠无序化分析(图4),发现M.albus AR氨基酸序列存在9个无序化区域,最长无序化区域由55个氨基酸组成,共有282个无序化氨基酸;人类AR氨基酸序列存在7个无序化区域,最长无序化区域由106个氨基酸组成,共有253个无序化氨基酸;鳜鱼AR氨基酸序列存在6个无序化区域,最长的无序化区域由78个氨基酸组成,共有168个无序化氨基酸;金钱鱼AR氨基酸序列存在8个无序化区域,最长的无序化区域由170个氨基酸组成,共有356个无序化氨基酸;石斑鱼AR氨基酸序列存在11个无序化区域,最长的无序化区域由74个氨基酸组成,共有275个无序化氨基酸。上述结果显示M.albus AR的无序化特征与其他4种生物的AR无序化特征差异较大,因此M.albus AR所执行的功能可能与其他4种生物AR所执行的功能有所不同,为进一步研究M.albus AR无序化区域结构和功能之间的关系提供了依据。
2.5 AR蛋白的磷酸化位点分析
磷酸化多数情况下发生在丝氨酸(Ser)、酪氨酸(Tyr)、苏氨酸(Thr)等氨基酸的残基上。在NetPhos 3.1上进行磷酸化位点预测(图5),发现M.albus AR的丝氨酸(Ser)磷酸化位点有42个,酪氨酸(Tyr)磷酸化位点有7个,苏氨酸(Thr)磷酸化位点有23个;人类AR的丝氨酸(Ser)磷酸化位点有45个,络氨酸磷酸化位点有10个,苏氨酸磷酸化位点有17个;鳜鱼AR的丝氨酸(Ser)磷酸化位点有36个,络氨酸(Tyr)磷酸化位点有4个,苏氨酸(Thr)磷酸化位点有17个;金钱鱼AR的丝氨酸(Ser)磷酸化位点有41个,络氨酸(Tyr)磷酸化位点有8个,苏氨酸(Thr)磷酸化位点有21个;石斑鱼AR的丝氨酸(Ser)磷酸化位点有37个,络氨酸(Tyr)磷酸化位点有10个,苏氨酸(Thr)磷酸化位点有22个。以上结果表明,这5种生物的AR蛋白能够被激酶磷酸化,进而实现AR蛋白的功能调控。