葡萄-藏红花间作系统下尖孢镰刀菌拮抗菌Cs12对藏红花根腐病的抑制作用
作者: 张晓祥 陶源源 钱晓东 周桂芬 李丽琴 沈翠芬
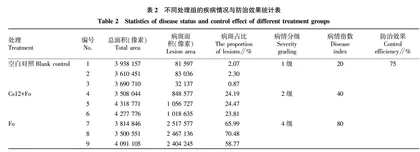
摘要 [目的]以藏红花单作和葡萄与藏红花间作土壤根系土为研究对象,分析微生物群落组成和差异表达菌群。[方法]对湖州现代农业示范园葡萄园区葡萄-藏红花间作和藏红花单作种植地块进行根系土壤采集。利用RoToR HDA菌落高通量筛选工作站构建细菌资源库。通过对间作菌群进行分离纯化以及平板对峙筛选出有益菌。通过分析藏红花的发病率来探究有益菌对藏红花根腐病的抑制作用。[结果]通过对间作菌群进行分离纯化以及平板对峙,分离出1种尖孢镰刀菌拮抗菌Cs12。球体接种试验表明Cs12使病情指数降低50%,对尖孢镰刀菌的防治效果达75%。[结论]分离出1种新发现的有益菌Cs12,这种菌具有较好地拮抗尖孢镰刀菌的作用。藏红花-葡萄间作系统不仅能够解决藏红花腐烂病问题,而且提高了土地资源利用率。这种生物防治方法对于防治其他植物的土传病害有一定的参考价值,有助于农业产业的可持续发展。
关键词 葡萄-藏红花间作;尖孢镰刀菌拮抗菌Cs12;藏红花根腐病;微生物群落多样性
中图分类号 S 435.67 文献标识码 A
文章编号 0517-6611(2024)24-0108-06
doi:10.3969/j.issn.0517-6611.2024.24.025
开放科学(资源服务)标识码(OSID):
Inhibition of Fusarium oxysporum Antagonist Cs12 to Saffron Root Rot Under Grape-saffron Intercropping
ZHANG Xiao-xiang,TAO Yuan-yuan,QIAN Xiao-dong et al
(Huzhou Central Hospital, Huzhou, Zhejiang 313099)
Abstract [Objective]To analyze the microbial community composition and differentially expressed flora in the root soil of saffron monocropped soil and grape and saffron intercropping soil.[Method]Root soil was collected in the grape garden of Huzhou Modern Agriculture Demonstration Garden in the plot of grape and saffron intercropping and saffron monocropping.We constructed the bacterial resource bank using the RoToR HDA colony high-throughput screening workstation.The beneficial bacteria were screened by isolation and purification of intercropping bacteria and plate confrontation.The incidence of saffron was analyzed to explore the inhibitory effect of beneficial bacteria on saffron root rot.[Result]Through the isolation and purification of intercropping bacteria and plate confrontation, we isolated an antagonistic antibacterial agent of Fusarium oxysporum Cs12.The inoculation experiment showed that Cs12 reduced the incidence index by 50%, and the control effect of CS12 against Fusarium oxysporum was 75%.[Conclusion]We have isolated a newly discovered beneficial bacterium Cs12, which has a good antagonistic effect against Fusarium oxysporum.The saffron-grape intercropping system can not only solve the problem of saffron rot, but also improve the utilization rate of land resources.This biological control method has certain reference value for the control of soil-borne diseases of other plants, and is helpful for the sustainable development of agricultural industry.
Key words Grape-saffron intercropping;Fusarium oxysporum antagonist Cs12;Saffron root rot;Microbial community diversity
随着人们生活水平的提高以及对健康的关注,食源性药物备受青睐。藏红花因其具有解郁安神[1]、抗炎抗氧化[2]和调节免疫[3]等功能得以广泛使用。为了满足日益增长的需求,提高其产量是一项重要的课题。然而,真菌所致的球茎腐烂病,尤其是尖孢镰刀菌(Fusarium oxysporum, Fo)导致世界各地藏红花大面积减产,被全球公认为是藏红花增产的主要限制因素[4]。一直以来,尽管化学杀菌剂,如多菌灵[5]、五氯硝基苯杀菌剂、双福拉坦和贝酸盐[6]等,成功控制球茎腐烂,提高了藏红花产量,但这些农药残留物对人类健康和环境保护构成威胁。
近年来,关于使用间作控制疾病的研究越来越多。间作控制植物病害的主要方式是提高作物抗性或减少致病菌的入侵。其机制的研究主要集中在根系分泌物(糖、氨基酸、有机酸、脂肪酸和次生代谢物)或者微生物组与病原体之间的相互作用上[7]。藏红花在同一地块连续单一种植往往会逐渐耗尽土壤中的某些养分和微生物多样性,容易受到生物或者非生物胁迫的影响,导致疾病的发生[8]。
笔者所在课题组前期开创性地使用藏红花-葡萄间作的方法,大大缓解了藏红花球茎腐烂病,提高产量。然而,藏红花-葡萄间作系统控制藏红花球茎腐烂病的原因尚不清楚。笔者对湖州现代农业示范园葡萄园区葡萄-藏红花间作和藏红花单作种植地块进行根系土壤采集,利用RoToR HDA菌落高通量筛选工作站构建了细菌资源库并筛选出有益菌。通过分析藏红花的发病率来探究有益菌对藏红花根腐病的抑制作用。藏红花-葡萄间作系统不仅能够解决藏红花腐烂病问题,而且提高了土地资源利用率。这种生物防治方法对于整治其他植物的土传病害有一定的参考价值,有助于农业产业的可持续发展。
1 材料与方法
1.1 田间试验和根系土壤采集
在湖州现代农业示范园葡萄园区葡萄-藏红花间作和藏红花单作种植地块进行根系土壤采集。间作根际土壤选取范围为距离葡萄树半径50~100 cm 藏红花植株。藏红花单独种植地块,按“S”型选择藏红花植株。用无菌铲挖出藏红花球茎,轻轻地清除松散地附着在球茎和根系上的土壤,并收集黏附在根系上的根际土,每10株合并作为一个生物学重复,单作和间作组均设置3个生物学重复。收集样本放在冰袋上带回实验室用于DNA提取、Illumina Miseq高通量测序和微生物分离培养。
1.2 微生物群基因组DNA提取、测序和数据处理
根据制造商的说明,使用FastDNASpin试剂盒(MP Biomedicals,U.S.)从藏红花单一栽培和葡萄-藏红花间作样本中提取微生物群基因组DNA。用1.0%琼脂糖凝胶电泳测定DNA质量。细菌16S rRNA基因的高变区V3~V4通过ABI GeneAmp9700 PCR热循环仪(ABI,CA,USA)用简并引物799F和1392R(包含孔和板特异性条形码)扩增。20 μL PCR反应混合物包括4 μL 5×Fast Pfu缓冲液、2 μL 2.5 mmol/L dNTP、0.8 μL每个引物(5 μmol/L)、0.4 μL Fast Pfu聚合酶、10 ng模板DNA和ddH2O。PCR扩增程序:95 ℃初始变性3 min,95 ℃30 s,55 ℃ 30 s,27个循环,72 ℃延伸45 s,72 ℃单次延伸10 min。最终的PCR产物由上海美吉生物医药科技有限公司,根据Majorbio Bio-Pharm Technology Co.的标准方案,在Illumina MiSeq PE300平台(Illumina,San Diego,USA)上对纯化的扩增子进行测序。原始测序读数存入NCBI序列读取档案(SRA)数据库(登录号:SRP473284)。
使用fastp(version 0.19.6)软件对双端原始测序序列进行质控,使用FLASH(version 1.2.11)软件进行拼接。使用UPARSE软件(version 7.1),根据97%的相似度对质控拼接后的序列进行操作分类单元OTU(Operational taxonomic unit)聚类并剔除嵌合体。将所有样本序列数抽平至42 042(推荐进行序列抽平),抽平后,每个样本的平均序列覆盖度仍可达99.7%。利用RDP classifier 比对Silva 16S rRNA基因数据库进行OTU物种分类学注释,置信度阈值为70%,并在不同物种分类水平下统计每个样本的群落组成。
1.3 数据分析
基于OTU信息,采用mothur软件计算Alpha多样性sob指数;使用基于bray-curtis距离算法的主坐标分析(PCoA分析)检验样本间微生物群落结构的相似性;并在属水平上,基于tax_summary_a文件夹中的数据表统计样本的物种丰度,结合Welch’ s t-test确定不同组间属水平丰度显著差异的菌群。以上所有的数据分析均在美吉生物云平台(https://cloud.majorbio.com)上进行。
1.4 根际土壤细菌的筛选鉴定
称取0.5 g土壤加入2 mL无菌水,180 r/min振荡20 min,所得悬液,利用RoToR HDA菌落高通量筛选工作站(英国SINGER)进行自动点样到96孔板上,尖孢镰刀菌在中间,点样结束后,用封口膜把板密封,放到37 ℃暗培养2~3 d。挑取抑菌带明显的菌落,采用划线法接种到改良NA培养基上(10 g蛋白胨,4 g牛肉膏,5 g 氯化钠,2 g海藻糖,20 g琼脂,加蒸馏水至1 000 mL,pH 7.0~7.4),对其进行纯化。挑取纯化的单菌落接种至30 mL NB液体培养基(10 g蛋白胨,4 g牛肉膏,5 g氯化钠,2 g海藻糖,pH 7.0~7.4)中重新培养,获得纯菌落。将纯化的细菌菌株保存在-80 ℃的25%甘油中。使用细菌通用引物进行菌落PCR扩增分离的细菌16S rDNA基因片段。引物序列:27F(5/-GGTTTGATCCTGTCTCAGA-3/)和1492R(5/-GTTACCTTGTTACGACTT-3/)。扩增条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环;最后在72 ℃下延伸5 min,终止反应。经琼脂糖凝胶电泳检测后的PCR产物送至上海生工生物工程(上海)股份有限公司进行序列测定。以PCR产物测得序列作为靶序列,在NCBI中的GenBank数据库搜索同源序列,下载与形态型序列最相似的参考序列。所有序列均已提交至NCBI数据库。用邻接法进行系统发育分析,确定待鉴定菌株的系统发育地位。经形态学、生理生化分析和16S rRNA分子生物学鉴定,确定根际细菌菌株。