18种观赏植物F3′5′H基因生物信息学分析
作者: 曾慧兰 高阳 卢毅
摘要 采用生物信息学方法对18种观赏植物类黄酮-3′5′-羟化酶基因(flavonoid-3′5′-hydroxylase,F3′5′H)的mRNA和氨基酸序列的理化性质、跨膜结构域、保守结构域、亚细胞定位、二级结构、三级结构和同源性进行预测与分析。结果表明,绝大多数观赏植物的F3′5′H为亲水性稳定蛋白质,以α 螺旋为主、无信号肽的跨膜蛋白质;大多数定位于内质网膜上;其三级结构模型为5ylw.1.A 铁锈醇合成酶,为单链蛋白,属于细胞色素P450基因家族;同源保守氨基酸序列为“LPPGP”“AGTDTS”和“PFGAGRRICAG”。
关键词 生物信息学;观赏植物;氨基酸序列;类黄酮-3′5′-羟化酶
中图分类号 S 68 文献标识码 A 文章编号 0517-6611(2023)07-0103-07
doi:10.3969/j.issn.0517-6611.2023.07.026
Bioinformatical Analysis of Flavonoid-3′5′-Hydroxylase Genes Originated from 18 Ornamental Plants
ZENG Hui-lan1,2,GAO Yang1,LU Yi1
(1.College of Life Science and Resources and Environment,Yichun University,Yichun,Jiangxi 336000; 2. Key Laboratory of Crop Growth,Development and Regulation,Yichun University,Yichun,Jiangxi 336000)
Abstract Predictive analyses of the mRNA sequence or amino acid sequences of the flavonoid 3′5′-hydroxylase gene (F3′5′H) originated from 18 ornamental plants and their physical and chemical parameters,transmembrane domains,conserved domains,subcellular localizations,secondary structure,tertiary structure and evolutionary relationships were explored using bioinformatics method.The results suggested that most F3′5′H of the 18 ornamental plants are hydrophilic stable proteins and transmembrane proteins ,which are mainly made of alpha-helix and no signal peptides; they are mostly located on endoplasmic reticulum membrane and assigned to 5ylw.1.A,which belongs to cytochrome P450 superfamily and is a monomer named ferruginol synthase in tertiary structure analysis;the Homologous conserved amino acid sequences are “LPPGP” “AGTDTS” and “PFGAGRRICAG”.
Key words Bioinformatical;Ornamental plants;Amino acid sequence;Flavonoid-3′5′-hydroxylase
基金项目 江西省作物生长发育调控实验室开放课题项目(KFJJ-201704);宜春学院博士科研启动项目(2103360117013)。
作者简介 曾慧兰(1986—),女,江西宜春人,讲师,博士,从事花色机理和园艺植物病害研究。
收稿日期 2022-04-12
花色是观赏植物的重要性状,植物的花色主要是由黄酮类化合物、类胡萝卜素和生物碱3类物质含量决定的[1],而花色苷是黄酮类化合物的主要组成之一,能控制花的橙红到蓝紫等颜色[2]。类黄酮-3′5′-羟化酶 (flavonoid -3′5′ -hydroxylase,F3′5′H) 是花色苷代谢途径中的关键酶之一[3]。F3′5′H催化花色素母体B环3′、5′位形成羟基集团,最终形成使花变蓝的飞燕草色素,被称为“蓝色基因”[4],所以它对蓝色花的育种具有非常重要的作用[5]。
目前,已从鹤望兰(Strelitzia reginae)、矮牵牛 (Petunia hybrida)、非洲堇 (Saintpaulia spp.)、细茎石斛 (Dendrobium moniliforme) 等多种植物中分离出F3′5′H基因并对其功能进行了深入研究[6-9]。黄敏玲等[8]采用RT-PCR和RACE方法从鹤望兰(Strelitzia reginae)黄色花萼中克隆到类黄酮生物合成途径关键基因SrF3′5′H,并分析了其在鹤望兰不同花期和花瓣中的表达含量。Qi 等[10]利用转基因技术和qRT-PCR验证了蝴蝶兰属(Phalaenopsis) PhF3′5′H在花色中的功能。严黎等[11]通过利用PCR方法扩增了丹参 (Salvia miltiorrhiza Bunge) 中的F3′5′H基因全长,并对该基因编码蛋白质的理化定性、亚细胞定位、结构域等进行了分析。方颖等[12]以华丽龙胆 (Gentiana sino-ornata) 为材料利用RT-PCR技术克隆了GsF3′5′H全长,并进行了生物信息学分析。也有不少研究利用转录组测序技术关注不同花色植物中F3′5′H的表达与功能,并进行生物信息学分析[2,13-14]。虽然当前植物中F3′5′H基因功能和表达情况的研究不少,但目前对各植物中F3′5′H进行系统比较生物信息学相关的详细分析鲜有报道。
该研究利用生物信息学原理和软件,对NCBI GenBank 数据库中已正式发表的18种观赏植物的F3′5′H基因全长mRNA和氨基酸序列进行理化性质、亚细胞定位、跨膜结构、保守区域、二级结构、三级结构和同源性进行分析,旨在为蓝色花卉的分子育种提供理论参考依据。
1 材料与方法
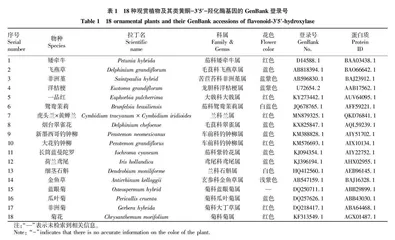
1.1 材料 从美国国家生物技术信息中心 (National Center for Biotechnology Information,NCBI) GenBank数据库中检索已正式注册、物种来源明确的18种观赏植物的F3′5′H基因全长mRNA核酸序列及其编码的氨基酸序列 (表1)。在这18种观赏植物中,蓝紫色系花卉有10种,红色系有6种,其他色系2种。
1.2 分析方法
运用ProtParam[15](https://web.expasy.org/protparam/) 对氨基酸的基本理化性质即氨基酸数、分子式、相对分子量、理论等电点、稳定性系数、带负电残基总数 (Asp+Glu)、带正电残基总数 (Arg+Lys)、亲疏水性和脂肪族氨基酸指数进行在线分析;通过SignalP 4.1[16](https://services.healthtech.dtu.dk/service.php?SignalP-4.1) 和SignalP 5.0[17] (https://services.healthtech.dtu.dk/service.php?SignalP-5.0) 对各序列的信号肽进行预测;利用TMHMM 2.0[18] (https://services.healthtech.dtu.dk/service.php?TMHMM-2.0) 分析氨基酸序列的跨膜结构域,并通过SMART[19] (http://smart.embl.de/smart/change_mode.pl) 验证跨膜区域;运用PSORT[20] (http://psort1.hgc.jp/form.html)在线软件对氨基酸序列进行亚细胞定位分析;利用WebLogo 3[21] (http://weblogo.threeplusone.com/create.cgi) 进行保守区域分析;利用SOPMA[22] (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 进行氨基酸序列的二级结构分析;利用SWISS-MODEL[23] (https://swissmodel.expasy.org/) 进行氨基酸序列的三级结构分析;利用MEGA 11[24] (https://www.megasoftware.net/) 进行上述序列的多重比对,寻找保守区域,并采用邻接法 (Neighbor-Joining,NJ) 迭代数为999次建立系统发育树,分析其在遗传学上的亲缘关系。
2 结果与分析
2.1 F3′5′H理化性质分析
通过ProtParam 在线软件对18种观赏植物F3′5′H基因所编码蛋白质的理化性质进行分析 (表2),结果表明,18种观赏植物F3′5′H基因编码的氨基酸数为502~535,平均为510.1;相对分子量为55 827.39~58 080.35,平均为56 737.91;理论等电点为6.52~9.31,平均为8.39;不稳定性系数为28.58~47.99,平均为38.365;带负电残基总数 (Asp+Glu)为49~60,平均为54.5;带正电残基总数 (Arg+Lys) 为52~66,平均为58.9;亲水性平均系数为-0.146~0.085,平均为-0.041;脂肪族氨基酸指数为90.22~106.54,平均为96.42。从表2可知,有11种观赏植物的F3′5′H为稳定的亲水性蛋白质,占比61.11%;有4种观赏植物的F3′5′H为不稳定的亲水性蛋白质,占比22.22%;有2种观赏植物的F3′5′H为稳定的疏水性蛋白质,占比11.11%;有1种观赏植物的F3′5′H为不稳定的疏水性蛋白质,占比5.56%。
2.2 F3′5′H信号肽和跨膜区域分析
信号肽的主要作用是促进蛋白分泌到胞外,通常位于氨基酸序列的N端,是引导新合成的蛋白质向分泌通路转移的短肽链[25],一般长度为5~30个氨基酸。通过SignalP 4.1和5.0对F3′5′H编码的蛋白质进行信号肽分析 (表3),结果表明,所测的16种观赏植物的F3′5′H均无信号肽,只有虎头兰×黄蝉兰和细茎石斛具有信号肽,信号肽所在位置分别为1~24位和1~20位氨基酸,且都与分泌 (Sec/secretory) 通路相关的能被一型信号肽酶 (SPI) 切除的信号肽。从表3可知,有15种植物的F3′5′H为跨膜蛋白,具有内膜区域、外膜区域和跨膜区域;有3种植物的F3′5′H无跨膜区域,只有外膜区域。经SMART分析验证,TMHMM 2.0所测的跨膜区域与SMART分析的结构域一致。
2.3 F3′5′H亚细胞定位分析
通过PSORT在线分析了8种观赏植物F3′5′H的亚细胞定位 (表4),根据定位频率和可靠性可知,该类蛋白位于内质网膜的可能性最大,为0.640~0.820,平均可靠性为0.786;其次为质膜、内质网腔、细胞核、过氧化物酶体、细胞外、高尔基体,最后为线粒体基质空间和叶绿体类囊体膜上。结合细胞生物学知识,可预测得F3′5′H可能有以下几类运输方式来行使催化功能:一类是F3′5′H蛋白在游离核糖体中合成后,通过信号肽锚定于内质网膜上,通过跨膜运输和膜泡方式分选到过氧化物酶体等细胞器行使催化功能,如虎头兰×黄蝉兰;第二类是在游离核糖体中合成后,通过信号肽锚定于内质网膜上,通过分泌方式分选到过氧化物酶体等细胞器行使催化功能,如细茎石斛;第三类是在游离核糖体中合成后转移至内质网膜上,以跨膜运输方式经内质网腔再直接运输到胞外行使催化功能,如飞燕草、一品红、烟台翠雀花、新墨西哥钓钟柳、大花钓钟柳、荷兰鸢尾;第四类是在游离核糖体中合成后转移至内质网膜上,通过跨膜运输方式分选到线粒体、叶绿体、高尔基体、过氧化物酶体等细胞器后行使催化功能,如非洲堇、长筒蓝曼陀罗、蓝眼菊、瓜叶菊、菊花;第五类是直接由细胞核内合成,不经跨膜方式,可能直接在细胞质中的线粒体、叶绿体等细胞器的特定部位中行使催化功能,如洋桔梗。